
Окислительно-восстановительная реакция, возникающая на электродах при прохождении электрического тока через раствор или расплав, называется электролизом. Отдельно выделяют электролиз растворов и электролиз расплавов. Рассмотрим, как происходит этот процесс на металлургических заводах.
Суть процесса
Движущей силой электролиза является электричество. Под воздействием энергии электрического тока происходит химическая реакция, не протекающая самопроизвольно.
Процессы восстановления и окисления происходят раздельно, на разных электродах. В качестве электродов взяты все материалы, способные проводить электрический ток. Чаще всего это металлы. В качестве неметалла используют углерод и из него изготавливают графитовые стержни. В редких случаях в качестве электрода выступают жидкости.
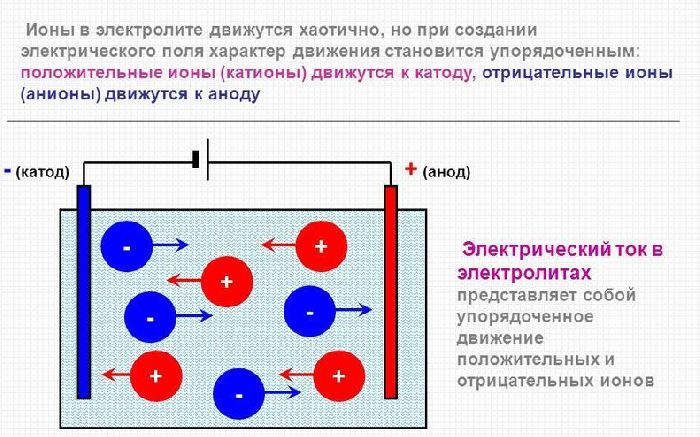
В расплав помещены два противоположно заряженных электрода, навстречу которым движутся разнозаряженные ионы.
Положительно заряженные катионы, у которых число электронов меньше числа протонов, движутся к отрицательному полюсу электрода – катоду. В качестве катода используется металлическая пластина из меди, латуни, цинка или алюминия.
Анионы движутся к аноду – положительному полюсу. Это отрицательно заряженные ионы, в которых число электронов превышает количество протонов. В процессе электролиза анод окисляется, то есть растворяется. Поэтому в качестве анода используется материал, не влияющий на химический процесс. Такой анод называется инертным электродом. Подходящие материалы – графит, платина.
Электролиз растворов сложнее плавления. В растворе участвуют ионы вещества и ионы растворителя, в расплавах — только ионы вещества. Основным продуктом электролиза расплава является металл (всегда катион). Побочные продукты:
- газ – кислород, водород, хлор;
- жидкости – вода, оксид серы (VI), бром.
На катоде происходит процесс восстановления, на аноде – процесс окисления.
Примеры
Рассмотрим схему электролиза на примере расплавов оксидов, оснований и солей, представленных в таблице.
|
Таять |
Описание |
Пример |
|
Окись |
– Восстановление металла на катоде: Men+ + ne– = Me0; – окисление кислорода на аноде: О-2 – 2е– = О2 |
2К2О = 4К + О2 |
|
База |
– Восстановление металла на катоде: Men+ + ne– = Me0; – окисление кислорода в составе гидроксидной группы на аноде: 4OH– – 4e = 2H2O + O2 |
4NaOH = 4Na + 2H2O + O2↑ или NaOH → Na+ + OH– |
|
Бескислородная соль |
– Восстановление металла на катоде: Men+ + ne– = Me0; – окисление бескислородного аниона на аноде: An- – ne– = A0 |
2NaBr = 2Na + Br2 или NaBr → Na+ + Br– |
|
Кислородная соль |
– Восстановление металла на катоде: Men+ + ne– = Me0; – окисление аниона кислорода на аноде: 2AO2- – 4e– = 2AO2- + O2 |
2Na2SO4 = 4Na + 2SO3↑ + O2↑ или Na2SO4 → 2Na+ + SO42- |
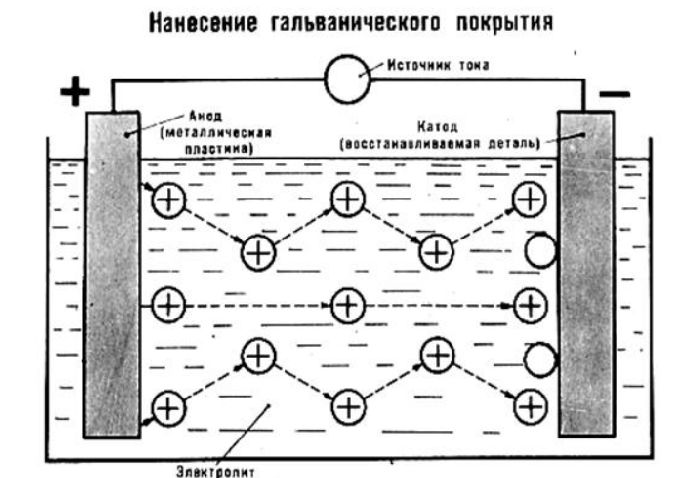
Электролиз является промышленным способом получения металлов, нанесения металлического покрытия, воспроизведения формы предметов.
Что мы узнали?
Электролиз – это окислительно-восстановительный процесс с участием электрического тока. В расплавах исходный материал разделяется с помощью электричества на катионы и анионы металлов. Положительно заряженные катионы стремятся к катоду – отрицательно заряженному электроду. Анионы – отрицательно заряженные ионы – оседают на положительно заряженном аноде. Поэтому восстановление происходит на катоде, а окисление – на аноде. С помощью плавильного электролиза получают металлы, наносят металлические покрытия и воспроизводят форму предметов.








Комментирование закрыто