
Гибридизация атомных орбиталей — это процесс, который позволяет нам понять, как атомы изменяют свои орбитали при образовании соединений. Итак, что же такое гибридизация и какие виды бывают?
Общая характеристика гибридизации атомных орбиталей
Гибридизация атомных орбиталей — это процесс, при котором различные орбитали центрального атома смешиваются, в результате чего образуются орбитали с идентичными свойствами.
Гибридизация происходит в процессе образования ковалентной связи.
Гибридная орбиталь имеет что-то вроде знака бесконечности или асимметричной перевернутой восьмерки, вытянутой в сторону от атомного ядра. Эта форма вызывает более сильное перекрытие гибридных орбиталей с орбиталями (чистыми или гибридными) других атомов, чем в случае чистых атомных орбиталей, и приводит к образованию более прочных ковалентных связей.
Идею гибридизации атомных орбиталей впервые выдвинул американский учёный Л. Полинг. Он считал, что атом, вступающий в химическую связь, имеет разные атомные орбитали (s-, p-, d-, f-орбитали), в результате чего происходит гибридизация этих орбиталей. Суть процесса состоит в том, что из разных орбиталей образуются эквивалентные друг другу атомные орбитали.
Типы гибридизации атомных орбиталей
Существует несколько типов гибридизации:
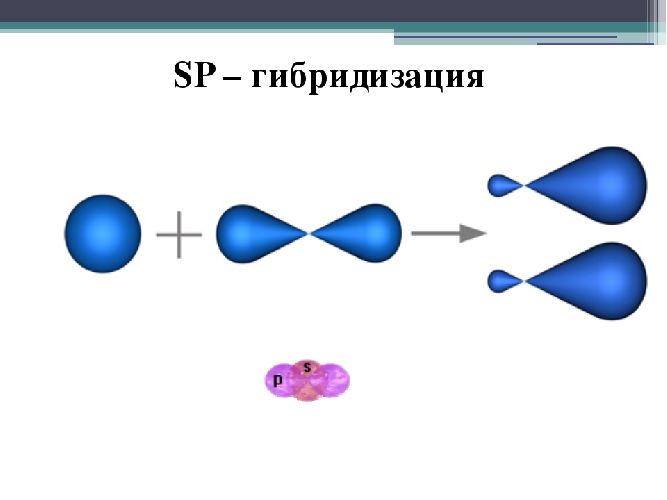
- sp-гибридизация. Этот тип гибридизации происходит, когда e-орбиталь и p-орбиталь смешиваются. В результате образуются две полные sp-орбитали. Эти орбитали расположены по направлению к атомному ядру таким образом, что угол между ними составляет 180 градусов.
- sp2-гибридизация. Этот тип гибридизации происходит при смешивании четной орбитали и двух p-орбиталей. В результате образуются три гибридные орбитали, расположенные в одной плоскости под углом 120 градусов друг к другу.
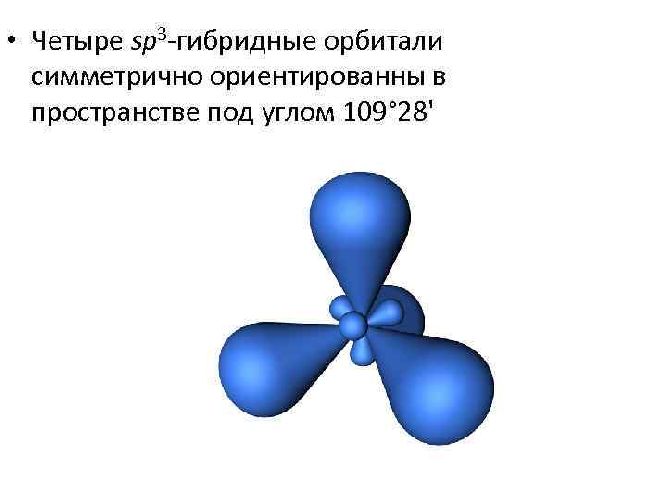
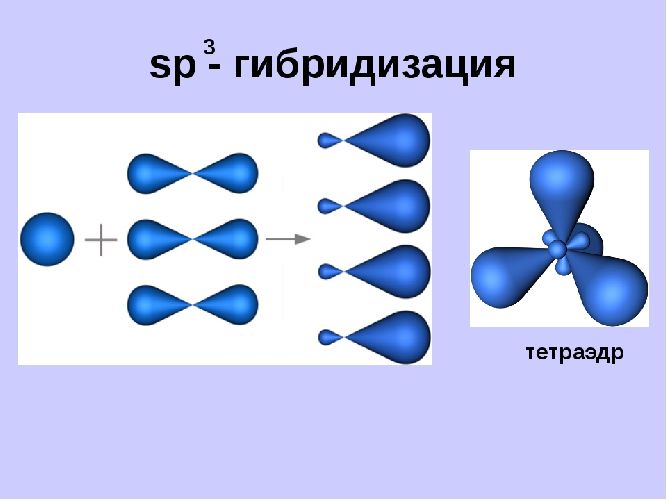
- sp3-гибридизация. Этот тип гибридизации происходит, когда смешиваются одна орбиталь и три p-орбитали. В результате образуются четыре полные sp3-орбитали. Эти орбитали направлены к вершине тетраэдра и расположены под углом 109,28 градуса друг к другу.
sp3-гибридизация характерна для многих элементов, например, атома углерода и других веществ IVА группы (CH4, SiH4, SiF4, GeH4 и др.)
Возможны и более сложные типы гибридизации с участием d-орбиталей атомов.
Что мы узнали?
Гибридизация — сложный химический процесс, при котором разные орбитали атома образуют одинаковые (эквивалентные) гибридные орбитали. Теорию гибридизации впервые высказал американец Л. Полинг. Существует три основных типа гибридизации: гибридизация sp, гибридизация sp2, гибридизация sp3. Существуют также более сложные типы гибридизации с участием d-орбиталей.








Комментирование закрыто