
Одним из самых распространенных простых веществ в земной коре является фосфор. В чистом виде не встречается, поскольку обладает высокой активностью и быстро реагирует. Часть живых организмов.
Строение
Фосфор находится в V группе, в третьем периоде таблицы Менделеева. Расположен под номером 15. Известны шесть изотопов фосфора, полученных искусственным путем.
Фосфор — элемент p-семейства. Атом фосфора состоит из положительно заряженного ядра +15 и 15 отрицательно заряженных электронов, расположенных в трех электронных оболочках. На внешнем энергетическом уровне расположены пять валентных электронов: 2 на s-орбитали, 3 на p-орбитали. В нормальном состоянии р-орбиталь остается неполной, а фосфор проявляет III валентность. В возбужденном состоянии электроны с s-орбитали переходят на р-орбиталь, а фосфор приобретает высшую валентность – V.
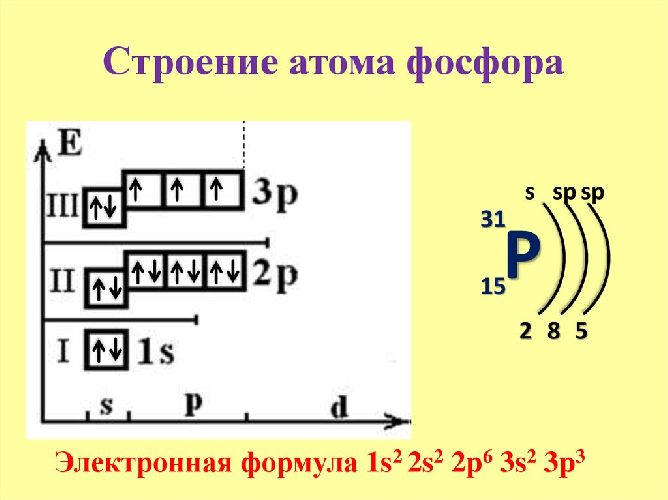
Электронная формула фосфора – 1s22s22p63s23p3.
Физические свойства
В обычных условиях фосфор постоянно находится в агрегатном состоянии. Это твердое кристаллическое вещество, нерастворимое в воде. Относительная атомная масса – 31 а.е.м., молярная масса – 30,9738 г/моль.
Фосфору свойственна аллотропия – способность видоизменяться. Модификации различаются физическими свойствами фосфора. Функции вида описаны в таблице.
|
Тип |
температура плавления, °С |
температура кипения, °С |
ρ, г/см3 |
Характеристика |
|
Белый |
44 |
280 |
1823 |
Из-за примесей может иметь желтый цвет. Самая мягкая модификация, нарезанная ножом, со специфическим запахом. Молекула состоит из четырех атомов (Р4), расположенных в форме тетраэдра. На воздухе окисляется с тлением, воспламеняется при 40°С. Токсичен, имеет малые смертельные дозы (0,05-0,15 г) |
|
Красный |
593 под давлением 4,36 МПа |
– |
2.4 |
Это достигается путем нагревания белого фосфора в отсутствие воздуха и под действием ионизирующего излучения. Это полимер (Pn), состоящий из нескольких молекул P4. Нетоксичный, не светится. Подожгите при 210°С. В обычных условиях он не плавится, а сразу испаряется. Белый фосфор образуется из паров |
|
Черный |
1000 под давлением 18·105 Па |
– |
2,69 |
Это достигается длительным нагреванием белого фосфора при температуре 230°С под высоким давлением. Имеет металлический блеск. Выглядит как графит, жирный на ощупь. Нерастворим даже в органических растворителях. Имеет свойства полупроводника. Возгорается при предварительном нагреве до 500°C |
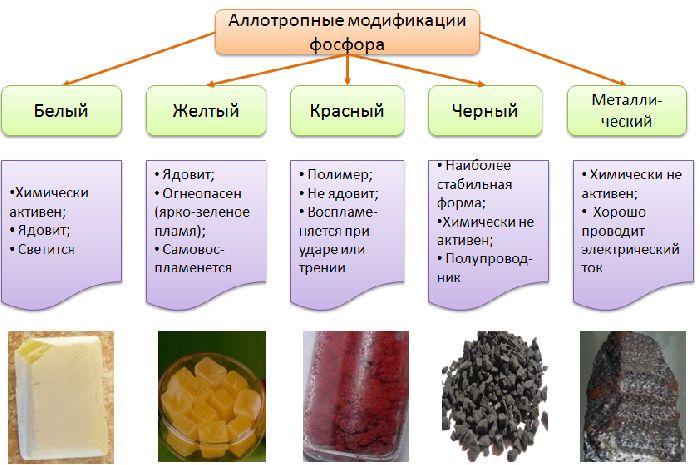
При обычных условиях фосфор имеет только три модификации. Однако под высоким давлением из чёрного фосфора можно получить металлический фосфор. Это самая плотная модификация (3,83 г/см3), проводящая электрический ток.
Химические свойства
Активность снижается при переходе от одной модификации к другой. Поэтому белый фосфор активен, металлический фосфор инертен.
Фосфор реагирует со многими простыми и сложными веществами. Функции химических свойств описаны в таблице.
|
Реакция |
Характеристики |
Уравнение |
|
С кислородом |
При избытке кислорода образуется оксид фосфора (V). Медленное окисление дает оксид фосфора (III |
– 4Р + 5О2 → 2Р2О5; – 4P + 3O2 → 2P2O3 |
|
С галогенами и неметаллами |
Восстанавливает |
– 2P + 3Cl2 → 2PCl3; – Б + П → БП |
|
С металлами |
Окисляется. Образует фосфиды |
3Мг + 2П → Мг3П2 |
|
С водой |
Реагирует с водяным паром с образованием фосфина и фосфорной кислоты. Красный фосфор реагирует с теплом и катализатором с образованием фосфорной кислоты |
– 8Р + 12Н2О → 5РН3 + 3Н3РО2; – 2P + 8H2O → 2H3PO2 + 5H2 |
|
С кислотой |
Связывается с водородом и заменяет неметаллы |
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O |
|
Со щелочами |
Образует фосфин |
4P + 3KOH + 3H2O → PH3 + 3KH2PO2 |
Фосфор не взаимодействует со свободным водородом.
Значение
В природе фосфор встречается в виде солей и минералов. В частности, он входит в состав апатита.
В организме животных и человека фосфор выполняет структурную функцию. Это содержит:
- белки;
- ДНК;
- АТФ;
- фосфолипиды;
- кость, нервная ткань, мышечная ткань.
Фосфор участвует в построении клеточной мембраны, в обмене веществ и в механизме сокращения мышц. Вместе с кальцием в виде фосфата кальция Ca3(PO4)2 придает прочность скелету.
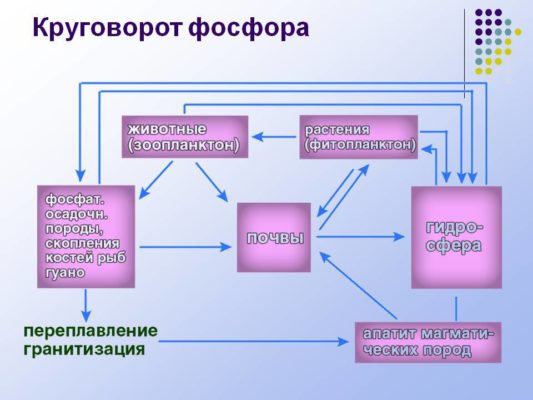
Фосфор участвует в круговороте веществ. Основным источником фосфора являются растения, которые получают его из почвы. Фосфор попадает в почву в результате гниения. Специальные бактерии преобразуют органические вещества, содержащие фосфор, в фосфаты — неорганические соединения, которые усваиваются растениями.
Что мы узнали?
Фосфор — один из важнейших элементов неорганической химии, входящий в состав живых организмов. Электронная конфигурация – 1с22с22п63с23п3. Имеет переменную валентность — III и V. Это твердый неметалл, образующий три аллотропные формы — белый, красный и черный фосфор. Формы различаются по физическим и химическим свойствам. Наиболее активен белый фосфор, который окисляется на воздухе. Элемент реагирует с кислородом, металлами, неметаллами, галогенами, кислотами, водой и щелочами. Фосфор не реагирует с водородом.








Комментирование закрыто