Водород – самый первый элемент в периодической таблице химических элементов, имеет атомный номер 1 и относительную атомную массу 1,0079. Каковы физические свойства водорода?
Физические свойства водорода
В переводе с латыни водород означает «рождающий воду». Еще в 1766 году английский ученый Г. Кавендиш собрал «горючий воздух», выделяющийся при действии кислот на металлы, и начал изучать его свойства. В 1787 году А. Лавуазье определил этот «горючий воздух» как новый химический элемент, входящий в состав воды.

У водорода существуют 2 стабильных изотопа – протий и дейтерий, а также радиоактивный – тритий, количество которого на нашей планете очень мало.
Водород — самый распространенный элемент в космосе. Солнце и большинство звезд имеют водород в качестве основного элемента. Этот газ также содержится в воде, нефти и природном газе. Общее содержание водорода на Земле составляет 1%.

Атом этого вещества содержит ядро и один электрон. Когда водород теряет электрон, он образует положительно заряженный ион, что означает, что он обладает металлическими свойствами. Но атом водорода также способен не только терять, но и приобретать электрон. В этом он очень похож на галогены. Следовательно, в таблице Менделеева водород принадлежит как к I, так и к VII группам. Неметаллические свойства водорода более выражены.
Молекула водорода состоит из двух атомов, связанных между собой ковалентной связью
В обычных условиях водород представляет собой бесцветный газообразный элемент, не имеющий запаха и вкуса. Он в 14 раз легче воздуха, а температура его кипения составляет -252,8 градуса Цельсия.
Таблица «Физические свойства водорода»
| состояние в нормальных условиях | газ без цвета, запаха и вкуса |
| растворимость | практически нерастворим в воде |
| плотность | самый легкий газ, в 14,5 раз легче воздуха |
| температура кипения | -253 градуса Цельсия |
| температура плавления | -259,1 градуса Цельсия |
Помимо физических свойств, водород обладает также рядом химических свойств. Водород при нагревании или под воздействием катализаторов реагирует с металлами и неметаллами, серой, селеном, теллуром, а также способен восстанавливать оксиды многих металлов.
Получение водорода
Из промышленных способов получения водорода (кроме электролиза водных растворов солей) следует отметить следующие:
- пропускают водяной пар через горячий уголь при температуре 1000 градусов:
- конверсия метана паром при температуре 900 градусов:
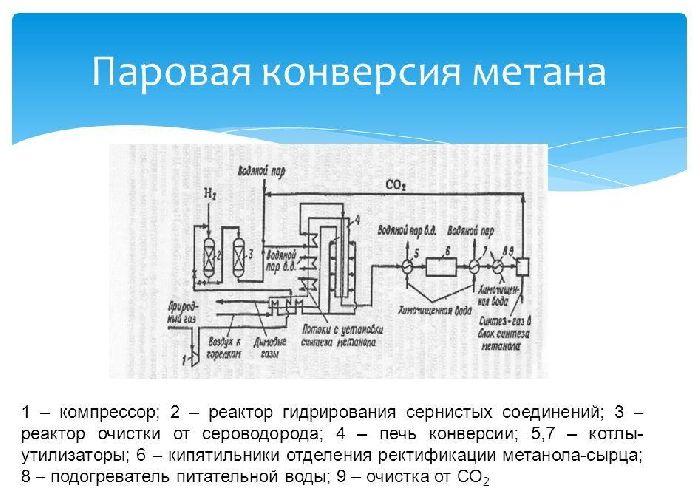
- разложение метана в присутствии катализатора (Ni) при температуре 400 градусов:
- метод глажки паром:
Что мы узнали?
Водород — бесцветный газ без запаха, который кипит при -253 градусах и плавится при -259,1 градусах. В статье представлен обзор физических и химических свойств водорода, а также способов его получения.








Комментирование закрыто