
Расположение электронов на энергетических оболочках или уровнях записывается с помощью электронных формул для химических элементов. Электронные формулы или конфигурации помогают представить атомную структуру элемента.
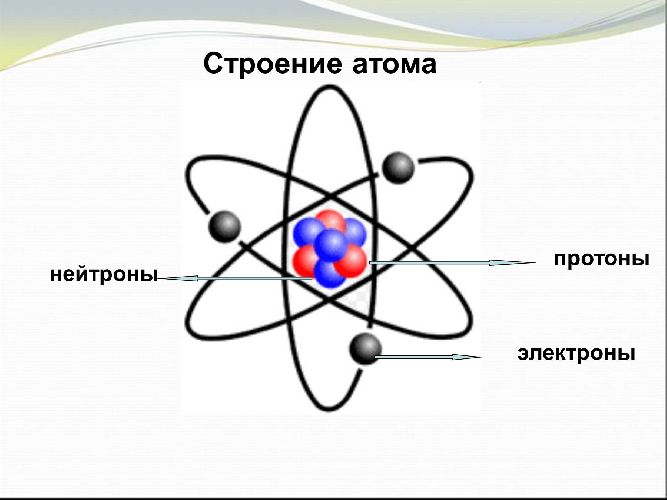
Строение атома
Чтобы читать электронные формулы, нужно понимать строение атома.
Атомы всех элементов состоят из положительно заряженного ядра и отрицательно заряженных электронов, расположенных вокруг ядра.
Электроны находятся на разных энергетических уровнях. Чем дальше электрон находится от ядра, тем большей энергией он обладает. Размер энергетического уровня определяется размером атомной орбитали или орбитального облака. Это пространство, в котором движется электрон.
Орбитали могут иметь различную геометрическую конфигурацию:
- s-орбитали сферические;
- p, d и f-орбитали имеют форму гантелей, лежащих в разных плоскостях.
Первый энергетический уровень атома всегда содержит s-орбиталь с двумя электронами (исключение составляет водород). Со второго уровня s- и p-орбитали находятся на одном уровне.
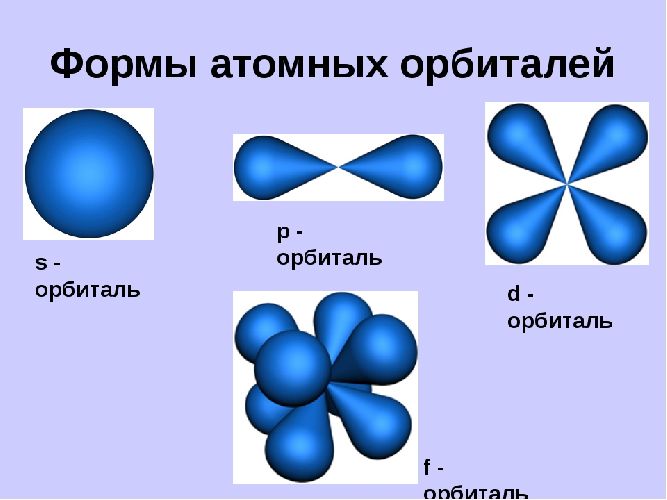
Орбитали существуют вне зависимости от нахождения на них электронов и могут быть заполненными или вакантными.
Запись формулы
Электронные конфигурации атомов химических элементов записываются по следующим принципам:
- каждому энергетическому уровню соответствует соответствующий порядковый номер, обозначаемый арабской цифрой;
- за номером следует буква, обозначающая орбиталь;
- над буквой пишется верхний индекс, соответствующий числу электронов на орбитали.
Примеры записей:
- кальций –
1с22с22п63с23п64с2;
- кислород –
1с22с22п4;
- углерод –
1с22с22п2.
Таблица Менделеева поможет вам записать электронную формулу. Число энергетических уровней соответствует номеру периода. Заряд атома и количество электронов обозначаются атомным номером элемента. Номер группы указывает, сколько валентных электронов находится на внешнем уровне.
Возьмем в качестве примера На. Натрий находится в первой группе, в третьем периоде, под номером 11. Это означает, что атом натрия имеет положительно заряженное ядро (содержащее 11 протонов), вокруг которого на трех энергетических уровнях расположены 11 электронов. На внешнем уровне находится один электрон.
Помните, что на первом энергетическом уровне находится s-орбиталь с двумя электронами, а на втором — s- и p-орбитали. Остается только пройти уровни и получить полную запись:
Для удобства созданы специальные таблицы с электронными формулами элемента. В длинной периодической таблице формулы также указаны в каждой ячейке элемента.
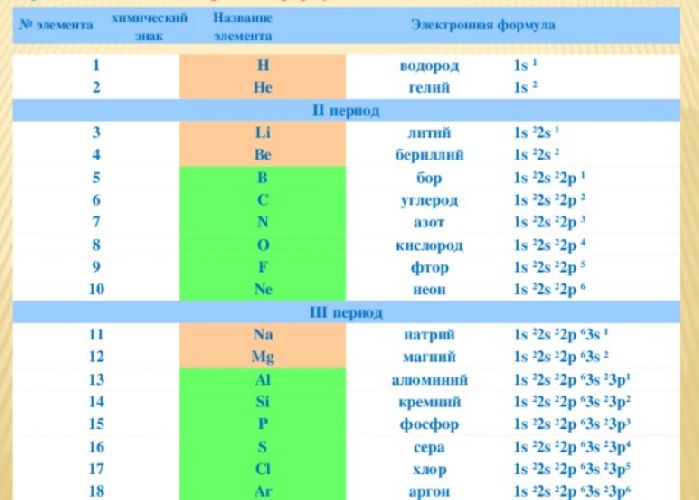
Для краткости в квадратных скобках записаны элементы, электронная формула которых совпадает с началом формулы элемента. Например, электронная формула магния – [Ne]3s2, неона – 1s22s22p6. Следовательно, полная формула магния – 1s22s22p63s2.
Что мы узнали?
Электронные формулы элементов отражают расположение электронов в атоме на разных орбиталях. Число электронов равно атомному номеру элемента, количество уровней равно номеру периода. Последний уровень содержит валентные электроны, соответствующие номеру группы элемента. Цифры в электронной формуле обозначают уровень, буквы — орбиталь, а нижние индексы — количество электронов на уровне.








Комментирование закрыто