
Процесс распада молекул на ионы называется электролитической диссоциацией. Теорию диссоциации впервые сформулировал шведский учёный Сванте Август Аррениус в 1887 году. Он изучал электропроводность растворов и пришёл к выводу, что вещества растворяются на заряженные частицы.
Суть процесса
По степени электропроводности все растворы или расплавы веществ делятся на две группы:
- электролиты – проводят электрический ток;
- неэлектролиты – не проводят электрический ток.
Электролиты и неэлектролиты одинаковых объемов и концентраций, помимо электропроводности, различаются и другими физическими свойствами. Например, электролиты имеют более высокую температуру кипения. Разница в физических свойствах объясняется большим количеством заряженных частиц, образующихся в растворе или расплаве.

В растворе под воздействием молекул воды молекулы вещества распадаются на положительно и отрицательно заряженные ионы – катионы и анионы. То же самое происходит и в расплаве при высоких температурах. Образование свободных ионов составляет суть процесса диссоциации.
Именно наличием большого количества заряженных частиц объясняется способность растворов или расплавов проводить электрический ток. Образующиеся ионы являются переносчиками электрического тока.
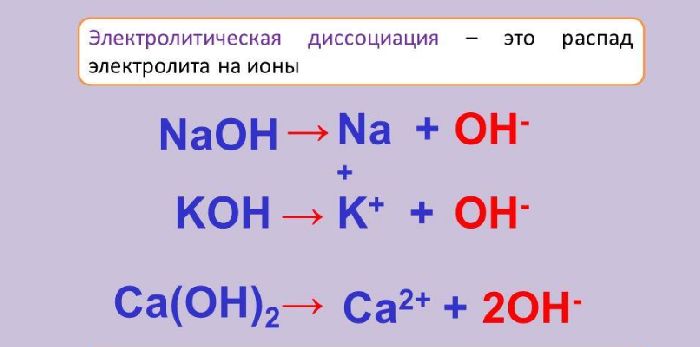
Электролиты в зависимости от степени диссоциации делятся на две группы:
- слабый – плохо растворяется на ионы;
- сильный — очень растворим, легко распадается на ионы.
Степень электролитической диссоциации представляет собой соотношение числа молекул, распавшихся на ионы, к общему числу молекул вещества:
Степень диссоциации зависит от температуры, давления, химических свойств электролита и растворителя. Электропроводность раствора зависит от степени диссоциации. Сильные электролиты проводят электричество лучше, чем слабые электролиты.
Только полярные молекулы подвергаются электролитической диссоциации. Такие молекулы связаны ковалентной полярной или ионной связью. Электролитическая диссоциация молекул – обратимый процесс.
Теория Аррениуса
Аррениус, изучив вопрос об электропроводности растворов, сформулировал теорию электролитической диссоциации. Основные положения теории до сих пор используются в химии:
- молекулы электролита распадаются на катионы и анионы;
- в растворе электролита катионы движутся к катоду, анионы – к аноду;
- одновременно с распадом молекул происходит обратный процесс — ионы объединяются в молекулы.
В 1891 году Иван Каблуков дополнил теорию Аррениуса. Он ввёл понятие сольватации – электростатического взаимодействия между частицами растворённого вещества и растворителя.
Диссоциации разных веществ
Сложные вещества можно описать с помощью электролитической диссоциации. Определения и описания веществ приведены в таблице.
|
Вещество |
Определение |
Примеры |
|
Кислота |
Электролит, который образует катионы водорода только при диссоциации — H+ |
– H3PO4 ↔ H+ + H2PO4–; – HCl → H+ + Cl– |
|
База |
Электролит, который при диссоциации образует анион ОН – гидроксид-ион. Амфотерные основания называются амфолитами. Они распадаются на катион водорода и анион-гидроксид-ион. |
– КОН → К+ + ОН–; – 2OH– + Zn2+ + 2H2O ↔ Zn(OH)2 + 2H2O ↔ [Zn(OH)4]2- + 2H+ |
|
Соль |
Электролит, образующий катион металла или аммония (NH4+) и анион кислотного остатка |
– (NH4)2SO4 → 2NH4+ + SO4-2; – Na3PO4 → 3Na+ + PO43- |
Что мы узнали?
Из урока в 8-9 классе мы узнали, что такое электролитическая диссоциация. В растворах под действием воды или в расплавах под действием температуры молекулы веществ делятся на заряженные частицы — ионы. Способность распадаться на ионы называется электролитической диссоциацией, а растворы, проводящие электричество, — электролитами. Быстрорастворимые вещества называются сильными электролитами, плохо растворимые — слабыми электролитами. Способность веществ распадаться на молекулы была изучена и описана в теории Сванте Августа Аррениуса. Сложные вещества расщепляются по-разному. Кислоты образуют H+, основания – OH–, соли – катион металла и анион кислотного остатка.








Комментирование закрыто