
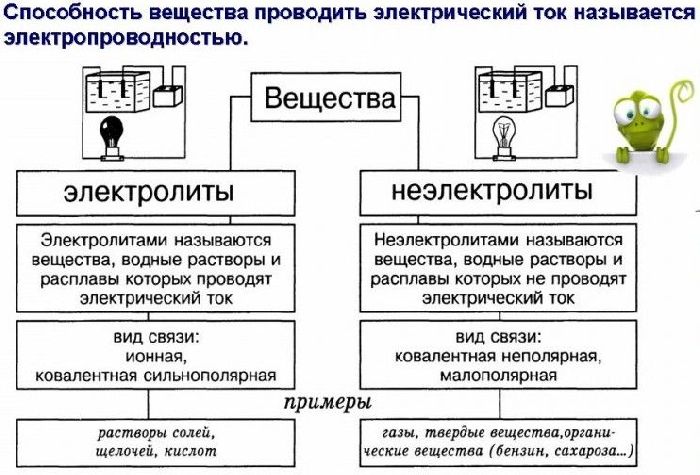
Электролиты – вещества, расплавы или растворы которых проводят электрический ток. Электролиты включают кислоты, основания и большинство солей.
Диссоциация электролитов
К электролитам относятся вещества с ионными или высокополярными ковалентными связями. Первые существуют в виде ионов еще до того, как они перейдут в растворенное или расплавленное состояние. К электролитам относятся соли, основания и кислоты.
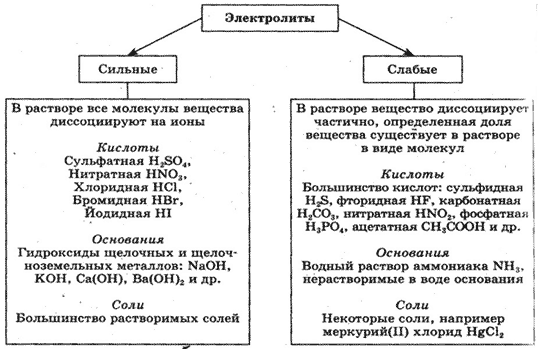
Различают сильные и слабые электролиты. Сильные электролиты при растворении в воде полностью диссоциируют на ионы. К ним относятся: почти все растворимые соли, многие неорганические кислоты (например, H2SO4, HNO3, HCl), гидроксиды щелочных и щелочноземельных металлов. Слабые электролиты при растворении в воде слабо диссоциируют на ионы. К ним относятся почти все органические кислоты, некоторые неорганические кислоты (например, Н2СО3), многие гидроксиды (кроме гидроксидов щелочных и щелочноземельных металлов).
Вода также является слабым электролитом.
Как и другие химические реакции, электролитическая диссоциация в растворах записывается в виде уравнений диссоциации. При этом для сильных электролитов процесс считают необратимым, а для электролитов средней силы и слабых — как обратимый процесс.
Кислоты являются электролитами, диссоциация которых в водных растворах происходит с образованием ионов водорода в виде катионов. Многоосновные кислоты диссоциируют постепенно. Каждый последующий этап протекает со все большим трудом, так как образующиеся ионы кислотных остатков являются более слабыми электролитами.
Основания – это электролиты, которые диссоциируют в водном растворе с образованием гидроксид-иона OH- в виде аниона. Образование гидроксид-иона является общей особенностью оснований и определяет общие свойства сильных оснований: щелочной характер, горький вкус, мыльный на ощупь, реакцию на индикатор, нейтрализацию кислот и др.
Щелочи, даже малорастворимые (например, гидроксид бария Ba(OH)2), диссоциируют полностью, например:
Соли – это электролиты, которые диссоциируют в водном растворе с образованием катиона металла и кислотного остатка. Соли диссоциируют не поэтапно, а полностью:
Теория электролитической диссоциации
Электролиты – вещества, которые подвергаются электролитической диссоциации в растворах или расплавах и проводят электрический ток за счет движения ионов.
Электролитической диссоциацией называется распад электролитов на ионы при растворении их в воде.
Теория электролитической диссоциации (С. Аррениус, 1887) в современном понимании включает в себя следующие положения:
- электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные (катионы) и отрицательные (анионы). Ионизация легче всего происходит у соединений с ионной связью (солей, щелочей), которые при растворении (эндотермический процесс разрушения кристаллической решетки) образуют гидратированные ионы.

Гидратация ионов является экзотермическим процессом. Соотношение энергетических затрат и выигрыша определяет возможность ионизации в растворе. При растворении вещества с полярной ковалентной связью (например, хлористого водорода HCl) диполи воды ориентируются к соответствующим полюсам растворенной молекулы, поляризуя связь и делая ее ионной, с последующей гидратацией ионов. Этот процесс обратим и может происходить как полностью, так и частично.
- гидратированные ионы стабильны и хаотично движутся в растворе. Под действием электрического тока движение становится направленным: катионы движутся к отрицательному поясу (катоду), а анионы — к положительному поясу (аноду).
- диссоциация (ионизация) — обратимый процесс. Полнота ионизации зависит от природы электролита (соли щелочных металлов диссоциируют практически полностью), его концентрации (с увеличением концентрации ионизация затрудняется), температуры (повышение температуры способствует диссоциации) и природы растворителя (ионизация происходит только в полярном растворителе, особенно в воде).
Что мы узнали?
Электролиты – это соли, кислоты и основания, которые могут проводить электричество. Электролиты бывают сильные и слабые. Также в статье приведены краткие сведения о соединениях электролитов.








Комментирование закрыто