
Класс ациклических ненасыщенных или ненасыщенных углеводородов, содержащих две двойные связи в молекуле, называют алкадиенами или диеновыми углеводородами. Подробнее о свойствах и свойствах алкадиенов читайте ниже.
Гомологи
Алкадиены отличаются от других классов наличием двух двойных связей. Общая формула диеновых углеводородов — CnH2n-2. Самый простой представитель класса — пропадии. Он содержит три атома углерода, соединенных двойными связями. Пропадиен образует гомологический ряд алкадиенов. Названия гомологов соответствуют названиям алканов с суффиксом «-диен». Примеры гомологов диенов:
- С3Н4 – пропадиен;
- С4Н6 – бутадиен;
- С5Н8 – пентадиен;
- С6Н10 – гексадиен;
- С7Н12 – гептадиен;
- С8Н14 – октадиен;
- С9Н16 – нонадиен;
- С10Н18 – десятилетие.
Физические свойства гомологов ряда пропадиена аналогичны свойствам алкенам. Пропадиен и бутадиен – газы, легко переходящие в жидкое состояние. Гомологи С5-С17 и их изомеры – жидкости. Высшие алкадиены с 18 и более атомами углерода – твёрдые соединения.
Изомерия
Гомологи пентадиена и выше образуют пространственную и структурную изомерию. Диенам свойственна геометрическая пространственная изомерия. Они образуют цис- и транс-изомеры.
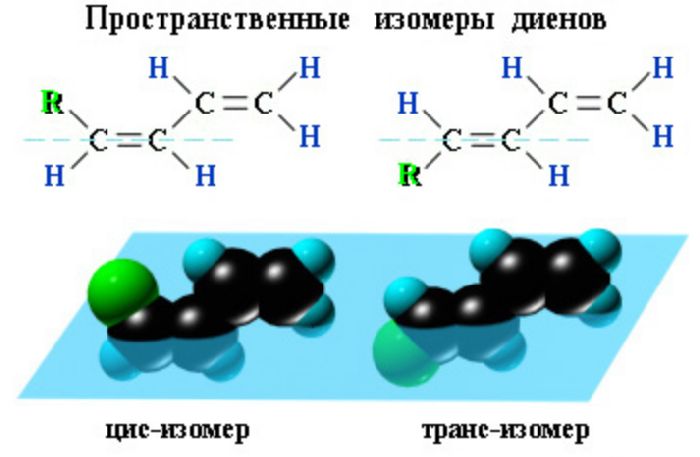
Структурная изомерия возникает в зависимости от углеродного скелета и положения кратных связей. При переносе метильной группы на другой атом углерода образуются структурные изомеры диенов. Например, 2-метилбутадиен-1,3 или изопрен представляет собой изомер пентадиена-1,3 с метильной группой при втором атоме углерода.

В зависимости от расположения связей друг с другом различают три типа диенов:
- кумулятивные – двойные связи расположены на одном атоме углерода (СН2=С=СН2);
- сопряженные – двойные связи, разделенные одинарной связью (СН2=СН-СН=СН2);
- изолированные – двойные связи разделены неограниченным количеством одинарных связей (СН2=СН-СН2-СН=СН2).
Диены получают из этанола, нефтепродуктов, галогеналканов.
Свойства
Благодаря множественным связям диены могут вступать в реакции присоединения. Атомы прикрепляются к месту разрыва связи. В зависимости от положения нескольких связей одни и те же реакции образуют вещества разной структуры. В таблице описаны наиболее важные химические реакции диенов.
|
Реакция |
Описание |
Уравнение |
|
Гидрирование |
Присоединение атома водорода в присутствии никеля |
СН2=СН-СН=СН2 + 2H2 → СН3-СН2-СН2-СН3 |
|
Галогенирование |
Образование тетрагалогеналканов |
CH2=CH-CH=CH2 + Br2 → CH2(Br)-CH(Br)-CH=CH2 или CH2(Br)-CH=CH-CH2-Br |
|
Гидрогалогенирование |
Реакция протекает в жидкой среде (спиртовой или водной) в присутствии катализатора — хлорида лития |
CH2=CH-CH=CH2 +HBr → CH3-CH(Br)-CH=CH2 или CH3-CH=CH-CH2-Br |
|
Полимеризация |
Производство искусственного каучука |
nCH2=CH-CH=CH2 -> (-CH2-CH=CH-CH2-)n |
Основное использование алкадиенов – синтез каучука.

Что мы узнали?
Диены или алкадиены представляют собой ненасыщенные ациклические углеводороды, содержащие двойные связи. Низшие алкадиены – это газы и жидкости, высшие (более 18 атомов углерода) – твердые вещества. Простейшим представителем класса являются пропадии, образующие гомологический ряд. Диенам свойственна пространственная и структурная изомерия. Структурная изомерия возникает в положении двойных связей и в углеродном скелете. Алкадиены более активны, чем насыщенные углеводороды. Вещества участвуют в реакции присоединения в месте разрыва двойной связи.








Комментирование закрыто