
Азотная кислота – одно из важнейших соединений азота. Химическая формула – HNO3. Так какими же физическими и химическими свойствами обладает это вещество?
Физические свойства
Чистая азотная кислота бесцветна, имеет резкий запах и имеет свойство «дымиться» на воздухе. Молярная масса составляет 63 г/моль. При температуре -42 градуса он переходит в твердое агрегатное состояние и превращается в белоснежную массу. Безводная азотная кислота кипит при 86 градусах. При смешивании с водой образует растворы, отличающиеся друг от друга концентрацией.
Это вещество является одноосновным, то есть всегда имеет карбоксильную группу. Среди кислот, являющихся мощными окислителями, азотная кислота является одной из самых сильных. Реагирует со многими металлами и неметаллами, органическими соединениями за счет восстановления азота
Нитраты – соли азотной кислоты. Чаще всего их используют в качестве удобрений в сельском хозяйстве
Химические свойства
Электронная и структурная формула азотной кислоты изображается следующим образом:
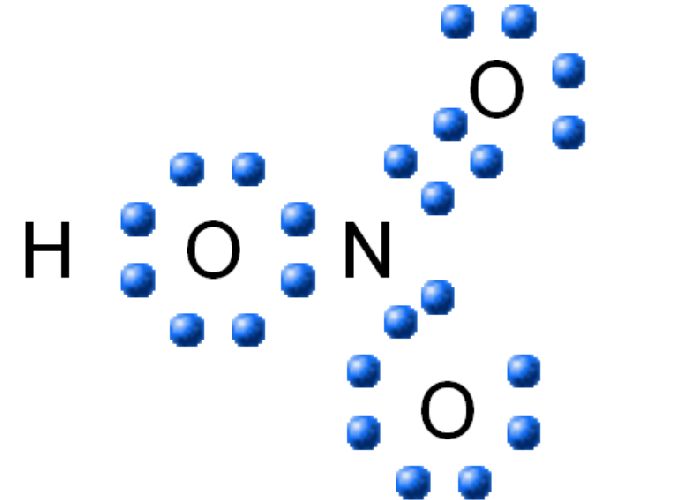
Концентрированная азотная кислота подвергается воздействию света и способна под его воздействием разлагаться на оксиды азота. Оксиды, в свою очередь, взаимодействуют с кислотой, растворяются в ней и придают жидкости желтоватый оттенок:
Вещество необходимо хранить в прохладном и темном месте. При повышении температуры и концентрации процесс разложения происходит гораздо быстрее. Азот в молекуле азотной кислоты всегда имеет валентность IV, степень окисления +5 и координационное число 3.
Поскольку азотная кислота является очень сильной кислотой, в растворах она полностью распадается на ионы. Реагирует с основными оксидами, основаниями и солями более слабых и летучих кислот.

Эта одноосновная кислота является сильным окислителем. Азотная кислота разъедает многие металлы. В зависимости от концентрации, активности металла и условий реакции ее можно снизить путем одновременного образования в соединениях соли азотной кислоты (нитрата.
При реакции азотной кислоты с малоактивными металлами образуется NO2:
Разбавленная азотная кислота в этой ситуации восстанавливается до NO:
Если несколько активных металлов реагируют с разбавленной азотной кислотой, выделяется NO2:
Очень разбавленная азотная кислота при взаимодействии с активными металлами восстанавливается до солей аммония:
Au, Pt, Rh, Ir, Ta, Ti устойчивы в концентрированной азотной кислоте. Он «пассивирует» металлы Al, Fe, Cr в результате образования оксидных пленок на поверхности металлов.
Смесь, образованная из одного объема концентрированной азотной и трех объемов концентрированной хлороводородной (соляной) кислоты называется «царской водкой».

Неметаллы окисляются азотной кислотой до соответствующих кислот, а азотная кислота в зависимости от концентрации восстанавливается до NO или NO2:
Азотная кислота способна окислять некоторые катионы и анионы, а также неорганические ковалентные соединения, например сероводород.
Азотная кислота взаимодействует со многими органическими веществами, при этом один или несколько атомов водорода в молекуле органического вещества заменяются нитрогруппами – NO2. Этот процесс называется нитрованием.
Что мы узнали?
Азотная кислота — бесцветная жидкость, но имеющая резкий запах. Особенность этой кислоты в том, что ее можно смешивать с водой в любых условиях. Азотная кислота также обладает рядом свойств. Он может реагировать, например, с металлами, неметаллами, оксидами, основаниями и т д.








Комментирование закрыто