
Из-за особенностей строения, химических и физических свойств ароматические углеводороды (арены) выделены в отдельный класс органической химии. Это сложные вещества общей формулы CnH2n-6.
Формула и строение бензола
Бензол – простейший представитель ароматических углеводородов с формулой C6H6. В 1865 году немецкий химик Фридрих Кекуле предложил структурную формулу бензола в виде шестиугольника с внутренними черточками.
По формуле оказалось, что бензол имеет кратные связи. Существование двойных связей указывает на возможность соединения атомов других веществ в местах их разрыва, т е вступление в реакции. Однако для бензола и других аренов характерна характерная реакция замещения водорода.
Чтобы понять, почему это происходит, давайте внимательно посмотрим на строение молекулы бензола.
Атомы углерода находятся в состоянии sp2-гибридизации. Это означает, что в атоме углерода одна s-орбиталь и две p-орбитали объединены (гибридизированы). Все орбитали находятся в одной плоскости и соединены с соседними атомами углерода σ-связями (концы p-орбиталей перекрываются), образуя условный шестиугольник. Вторая σ-связь образуется с атомами водорода.
Перпендикулярно плоскости, в которой расположены гибридизованные орбитали атомов углерода, связанных с атомами водорода, расположена третья негибридизованная р-орбиталь. Концы р-орбиталей всех атомов углерода в шестиугольнике взаимодействуют друг с другом: электроны р-орбиталей принадлежат всем атомам углерода бензольного кольца. Такая прочная связь называется сопряженной ароматической π-системой или π-электронным облаком.
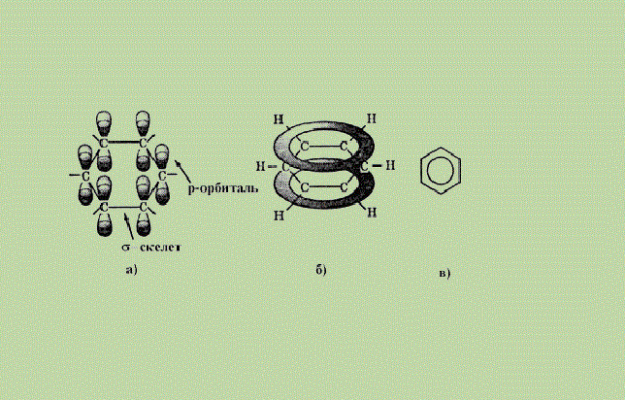
Оказывается, ароматические углеводороды не имеют двойных связей, поэтому реакция соединения невозможна.
Более правильную формулу предложил Лайнус Полинг. В ней вместо внутренних чёрточек рисую окружность, указывающую на взаимосвязь атомов углерода.
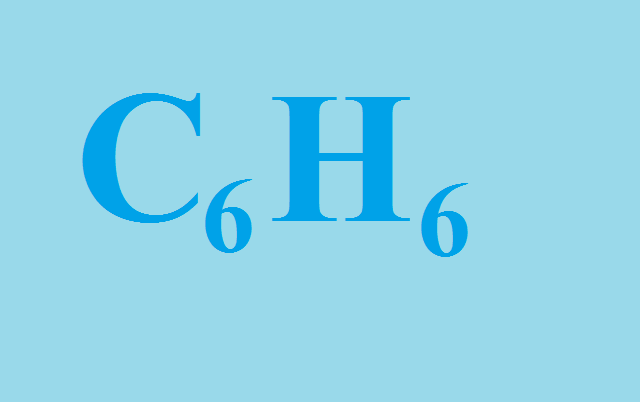
Гомологи и изомерия
Бензол образует гомологический ряд. Гомологи бензола, помимо бензольного кольца, включают маргинальные углеводородные радикалы с одинарной связью:
- бензол – С6Н6;
- метилбензол (толуол) – C7H8;
- этилбензол – C8H10;
- пропилбензол – C9H12;
- бутилбензол (дурол) – C10H14.
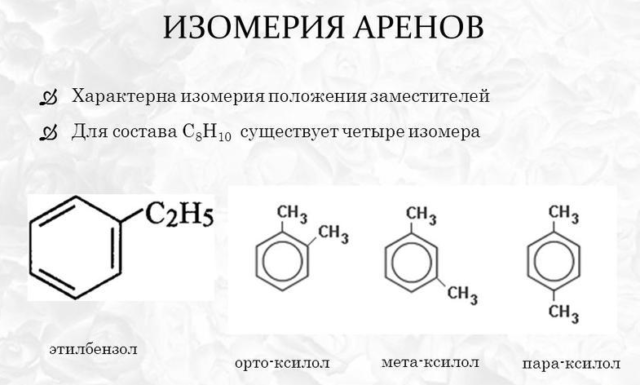
Для гомологов бензола характерны два типа изомерии:
- по построению радикала;
- в зависимости от положения заместителей в бензольном кольце.
При изменении структуры углеводородного радикала метильные группы могут «перемещаться» или соединяться с другими атомами углеродной цепи. Чем сложнее радикал, тем больше изомеров он содержит. Например, пропилбензол содержит радикал, содержащий три атома углерода. Образует один изомер – изопропилбензол или кумол. Бутилбензол образует три изомера.
При изменении положения метильной группы указывается количество атомов углерода, к которым присоединился радикал. Список групп идет от самого молодого гомолога к самому старшему. Например, 1-метил-2-этилбензол, 1,2,4-триметилбензол.
Если в соединении присутствуют две метильные группы, используются три приставки, указывающие положение радикалов относительно друг друга:
- орто- (о-) – расположены у восстановленных атомов;
- мета- (м-) – разделяются одним атомом;
- пара- (п-) – расположенный друг, натрадый друг.
Например, название мета-диметилбензол указывает на то, что две метильные группы расположены поперек одного атома углерода в бензольном кольце.
К бензольному кольцу могут присоединяться радикалы, содержащие двойные связи. Некоторые соединения имеют совмещённые кольца. В этих случаях вещества относятся к аренам, но не являются гомологами бензола, так как не обладают аналогичными свойствами.
Свойства
В присутствии катализатора осуществляются реакции замещения:
- галогенирование –
C6H6 + Cl2 → C6H5Cl + H2O;
- нитрование –
C6H6 + HNO3 → C6H5NO2 + H2O;
- сульфирование –
C6H6 + H2SO4 → C6H6O3S + H2O;
- алкилирование –
C6H6 + R-Cl → C6H6– R + HCl.
Арены – жидкости или твёрдые вещества. Бензол – бесцветная пахнущая жидкость, нерастворимая в воде.
Что мы узнали?
Арены или ароматические углеводороды отличаются наличием бензольного кольца, образованного π-электронным облаком. Гомологи бензола схожи по строению и свойствам. Они отличаются от углеводородных радикалов, содержащих только одинарные связи. Для аренов характерна изомерия на углеродном скелете: меняется структура радикала и его положение в бензольном кольце. Арены вступают в реакции замещения посредством водородной связи.








Комментирование закрыто