
Ациклические ненасыщенные углеводороды с одной двойной связью между атомами углерода называются алкенами. Простейшим алкеном является этилен (C2H4), образующий гомологический ряд.
Описание
Алкены — класс веществ органической химии. Другое название класса — олефины. Общая формула алкенов — CnH2n.
Алкены обязательно содержат одну двойную связь, которая может располагаться в любом месте молекулы. Атомы, соединенные двойной связью, находятся в состоянии sp2-гибридизации, т.е в соединении атомов участвуют одна s- и две p-орбитали. В этом случае p-орбиталь остается свободной.
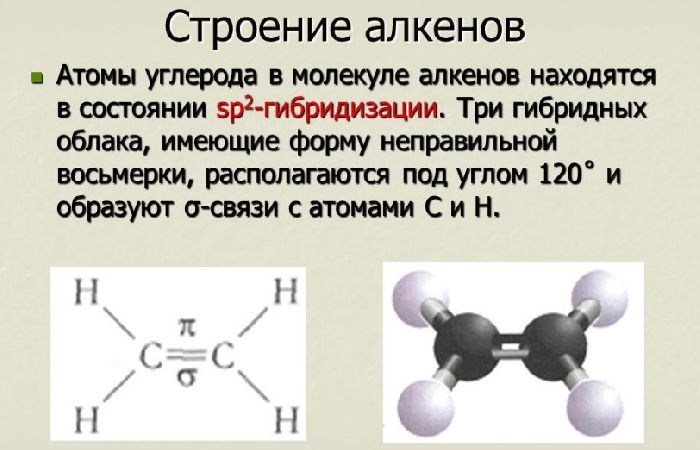
Алкены, в зависимости от нахождения в гомологическом ряду, отличаются физическими свойствами. Первые три алкена в гомологическом ряду – газы. Вещества, содержащие от пяти до 17 атомов углерода, относятся к жидкостям. Высшие алкены, содержащие более 17 атомов углерода, являются твёрдыми веществами.
Номенклатура
Названия алкенов в гомологическом ряду соответствуют названиям алканов, но суффикс «-ан» заменен на «-ен». Названия и формулы веществ приведены в таблице алкенов.
|
Имя |
Формула |
|
Этилен (этилен) |
C2H4 |
|
Пропен (пропилен) |
C3H6 |
|
Бутен (бутилен) |
C4H8 |
|
Пент |
C5H10 |
|
Ведьма |
C6H12 |
|
Тетради |
C7H14 |
|
Октябрь |
C8H16 |
|
Никто |
C9H18 |
|
Вот и все |
С10Н20 |
Имя может содержать две цифры. В начале названия цифра указывает положение заместителей (в формуле пишутся в скобках). Вторая цифра в конце названия указывает положение двойной связи. Нумерацию атомов начинают с того конца, к которому ближе всего двойная связь. Например, название «5-метилгексен-2» указывает на то, что к пятому атому гексена присоединен метил, а двойная связь находится между вторым и третьим атомами.
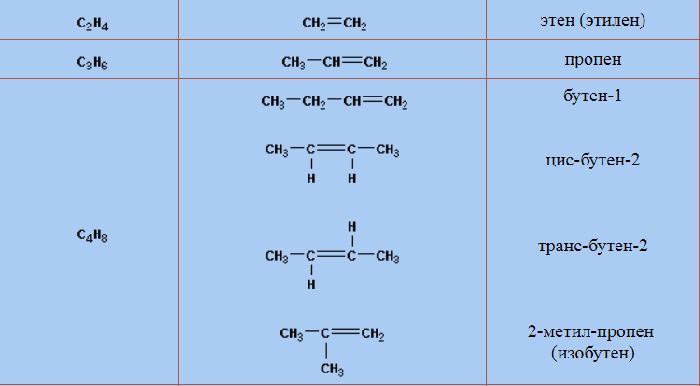
Алкены, кроме этилена, имеют изомеры. Пропилену свойственна межклассовая изомерия. Его единственным изомером является циклопропан (C3H6). Изменения углеродного скелета и положения двойной связи, а также структурная изомерия характерны веществам, начиная с бутилена (бутен-1, бутен-2, изобутилен, цис-бутен-2, транс-бутен-2).
Получение
Алкены, в отличие от алканов, в природе практически не встречаются. Растения содержат небольшое количество этилена. Некоторые феромоны насекомых относятся к классу алкенов.
Олефины синтезируют в промышленных и лабораторных условиях. В промышленности используется крекинг – высокотемпературная переработка нефти, а также дегидратация (обезвоживание) спиртов.
В лабораториях используются:
- дегидратация спиртов в присутствии сильных кислот;
- дегидрогалогенирование – удаление галогеноводорода путем нагревания;
- дегалогенирование дигалогеналканов – удаление галогенов в присутствии цинка;
- синтез Гофмана – разложение аммониевых оснований;
- реакция Чугаева – взаимодействие спиртов с сероуглеродом и гидроксидом натрия;
- метод Виттига – взаимодействие карбонильных соединений с алкилиденфосфоранами;
- метод Коупа — разложение N-оксидов третичных аминов.
Используются и другие методы. Например, реакция Бурда, Кнёвенагеля, Перкина, Кори-Винтера.
Химические свойства
Алкены являются активными веществами. Они реагируют:
- с водородом:
СН3-СН2-СН=СН2 + Н2 -> СН3-СН2-СН2-СН3;
- с галогенами:
СН2=СН2 + Cl2 → Cl-CH2-CH2-Cl;
- с галогеноводородами:
СН2=СН2 + HCl → СН3-СН2-Cl;
- с водой:
СН2=СН2 + Н2О → СН3-СН2ОН;
- с кислородом:
CH2=CH2 + 3O2 → 2CO2↑ + 2H2O.

Алкены способны образовывать полимеры. Реакция полимеризации протекает в присутствии катализатора под действием давления и высокой температуры. Полимеризация помогает получить прочные материалы: полиэтилен, полипропилен, поливинилхлорид.
Что мы узнали?
Из темы урока мы узнали, что такое алкены. Это класс органических веществ, которые содержат одну двойную связь между атомами углерода. Названия алкенов образуются добавлением суффикса «-ен». В зависимости от числа атомов углерода алкены могут находиться в газообразном, жидком или твердом состоянии. Алкены получают искусственным путем, поскольку в природе вещества практически не встречаются. Это активные соединения, которые реагируют с неорганическими веществами.








Комментирование закрыто