
Для определения условного заряда атомов в окислительно-восстановительных реакциях воспользуйтесь таблицей окисления химических элементов. В зависимости от свойств атома элемент может иметь положительную или отрицательную степень окисления.
Что такое степень окисления
Условный заряд атомов элементов в сложных веществах называется степенью окисления. Величина заряда атомов регистрируется в окислительно-восстановительных реакциях, чтобы понять, какой элемент является восстановителем, а какой окислителем.
Степень окисления связана с электроотрицательностью, которая показывает способность атомов принимать или отдавать электроны. Чем выше значение электроотрицательности, тем больше способность атома терять электроны в реакциях.

Степень окисления может иметь три значения:
- ноль – атом покоится (все простые вещества имеют степень окисления 0);
- положительный – атом отдает электроны и является восстановителем (все металлы, некоторые неметаллы);
- отрицательный – атом принимает электроны и является окислителем (большинство неметаллов).
Например, степени окисления в реакции натрия с хлором следующие:
В реакции металлов с неметаллами металл всегда является восстановителем, а неметалл – окислителем.
Как определить
Это таблица, показывающая все возможные степени окисления элементов.
|
Имя |
Символ |
Степень окисления |
|
Водород |
ЧАС |
+1, -1 |
|
Гелий |
Он |
0 |
|
Литий |
Ли |
+1 |
|
Бериллий |
Быть |
+2 |
|
Жизнь |
Б |
-1, 0, +1, +2, +3 |
|
Углерод |
С |
-4, -3, -2, -1, 0, +2, +4 |
|
Азот |
Н |
-3, -2, -1, 0, +1, +2, +3, +4, +5 |
|
Кислород |
О |
-2, -1, 0, +1, +2 |
|
Фтор |
Ф |
-1 |
|
Неон |
Нет |
0 |
|
Натрий |
Сейчас |
+1 |
|
Магний |
Мг |
+2 |
|
Алюминий |
Угорь |
+3 |
|
Кремний |
Сказать |
-4, 0, +2, +4 |
|
Фосфор |
П |
3, 0, +3, +5 |
|
Сера |
С |
2, 0, +4, +6 |
|
Хлор |
Кл |
1, 0, +1, +3, +5, +7, редко +2 и +4 |
|
Аргон |
Год |
0 |
|
Калий |
К |
+1 |
|
Кальций |
О |
+2 |
|
Скандий |
Наук |
+3 |
|
Титан |
Десять |
+2, +3, +4 |
|
Ванадий |
В |
+2, +3, +4, +5 |
|
Хром |
Кр |
+2, +3, +6 |
|
Марганец |
Мистер |
+2, +3, +4, +6, +7 |
|
Железо |
Сказочный |
+2, +3, редко +4 и +6 |
|
Кобальт |
Ко |
+2, +3, редко +4 |
|
Никель |
Девять |
+2, редко +1, +3, +4 |
|
Медь |
Cu |
+1, +2, редко +3 |
|
Цинк |
Зн |
+2 |
|
Галлий |
Идти |
+3, редко +2 |
|
Германий |
Давать |
-4, +2, +4 |
|
Мышьяк |
Как |
-3, +3, +5, редко +2 |
|
Селен |
Видеть |
-2, +4, +6, редко +2 |
|
Бром |
Братан |
-1, +1, +5, редко +3, +4 |
|
Криптон |
НОК |
0 |
|
Рубидий |
Рупий |
+1 |
|
Стронций |
Старший |
+2 |
|
Иттрий |
Да |
+3 |
|
Цирконий |
Мистер |
+4, редко +2, +3 |
|
Ниобий |
Примечание |
+3, +5, редко +2, +4 |
|
Молибден |
Мо |
+3, +6, редко +2, +3, +5 |
|
Технеций |
Тс |
+6 |
|
Рутений |
Грубый |
+3, +4, +8, редко +2, +6, +7 |
|
Родий |
Резус |
+4, редко +2, +3, +6 |
|
Палладий |
ПД |
+2, +4, редко +6 |
|
Серебро |
Аг |
+1, редко +2, +3 |
|
Кадмий |
CD |
+2, редко +1 |
|
Индий |
В |
+3, редко +1, +2 |
|
Банка |
Сн |
+2, +4 |
|
Сурьма |
Сб |
-3, +3, +5, редко +4 |
|
Теллур |
Чай |
-2, +4, +6, редкий |
|
Йод |
Я |
-1, +1, +5, +7, редко +3, +4 |
|
Ксенон |
Ксе |
0 |
|
Цезий |
Cs |
+1 |
|
Барий |
Ба |
+2 |
|
Лантан |
Позволять |
+3 |
|
Церий |
Се |
+3, +4 |
|
Празеодим |
Пер |
+3 |
|
Неодим |
Нд |
+3, +4 |
|
Прометий |
Вечера |
+3 |
|
Самарий |
См |
+3, редко +2 |
|
Европий |
Евросоюз |
+3, редко +2 |
|
Гадолиний |
Б-г |
+3 |
|
Тербий |
Тб |
+3, +4 |
|
Диспрозий |
Умереть |
+3 |
|
Гольмий |
Хо |
+3 |
|
Эрбий |
Является |
+3 |
|
Тулий |
Тм |
+3, редко +2 |
|
Иттербий |
Иб |
+3, редко +2 |
|
Лютеций |
Спать |
+3 |
|
Гафний |
Хф |
+4 |
|
Тантал |
Палец на ноге |
+5, редко +3, +4 |
|
Вольфрам |
Вт |
+6, редко +2, +3, +4, +5 |
|
Рений |
Ре |
+2, +4, +6, +7, редко -1, +1, +3, +5 |
|
Осмий |
Нас |
+3, +4, +6, +8, редко +2 |
|
Иридий |
ИК |
+3, +4, +6, редко +1, +2 |
|
Платина |
Пт |
+2, +4, +6, редко +1, +3 |
|
Золото |
Ой |
+1, +3, редко +2 |
|
Меркурий |
Ртуть |
+1, +2 |
|
Талия |
Тел |
+1, +3, редко +2 |
|
Вести |
Pb |
+2, +4 |
|
Висмут |
Пчела |
+3, редко +3, +2, +4, +5 |
|
Полоний |
Пу |
+2, +4, редко -2, +6 |
|
Астат |
На |
– |
|
Радон |
Сырой |
0 |
|
Франция |
Пт |
– |
|
Радий |
Сырой |
+2 |
|
Актиний |
Переменный ток |
+3 |
Или используйте эту версию таблицы в классе.
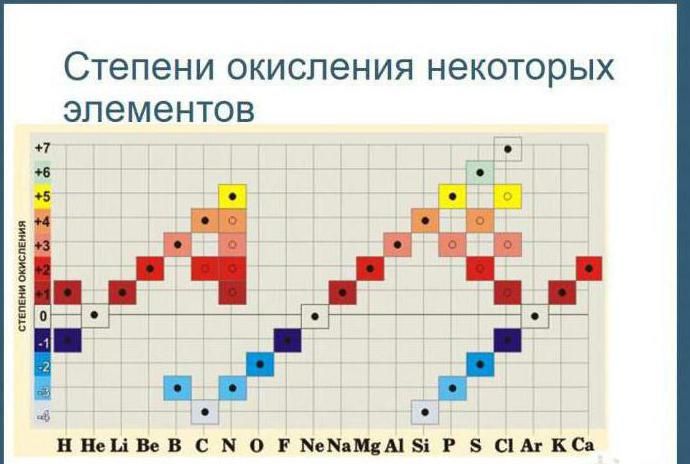
Кроме того, степени окисления химических элементов можно определить по таблице Менделеева:
- высшая степень (максимально положительная) совпадает с номером группы;
- чтобы определить минимальное значение степени окисления, из номера группы вычтите восемь.
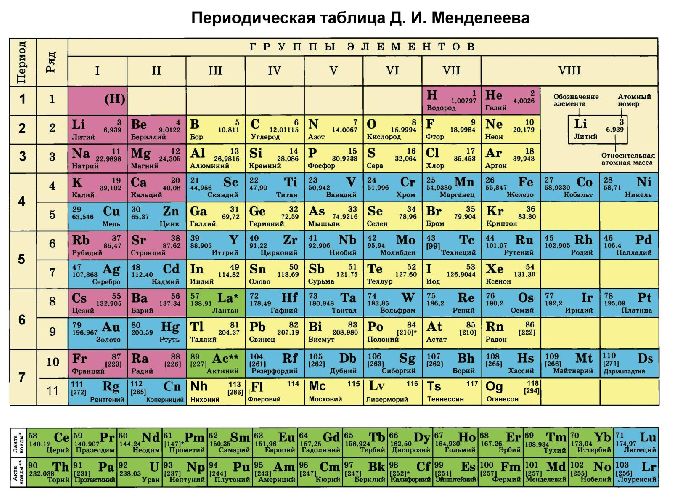
Большинство неметаллов имеют положительные и отрицательные степени окисления. Например, кремний находится в группе IV, что означает, что его максимальная степень окисления равна +4, а минимальная — -4. В соединениях неметаллов (SO3, CO2, SiC) окислителем является неметалл с отрицательной степенью окисления или с высоким значением электроотрицательности. Например, в соединении PCl3 фосфор имеет степень окисления +3, хлор -1. Электроотрицательность фосфора 2,19, хлора 3,16.
Второе правило не работает для щелочных и щелочноземельных металлов, которые всегда имеют одну положительную степень окисления, равную номеру группы. Исключение составляют магний и бериллий (+1, +2). Также имеет постоянную степень окисления:
- алюминий (+3);
- цинк (+2);
- кадмий (+2).
Другие металлы имеют переменную степень окисления. В большинстве реакций они действуют как восстановитель. В редких случаях они могут быть окислителями с отрицательной степенью окисления.
Фтор – самый мощный окислитель. Его степень окисления всегда -1.
Что мы узнали?
С 8 класса мы узнали о степени окисления. Это условная величина, показывающая, сколько электронов может отдать или забрать атом в ходе химической реакции. Значение связано с электроотрицательностью. Окислители принимают электроны и имеют отрицательную степень окисления, а восстановители отдают электроны и имеют положительную степень окисления. Большинство металлов являются восстановителями с постоянной или переменной степенью окисления. Неметаллы могут обладать окислительными и восстановительными свойствами в зависимости от вещества, с которым они реагируют.








Комментирование закрыто