
Азотную кислоту впервые начали производить в 17 веке. Современный лабораторный метод предполагает получение кислоты из нитратов. Для получения азотной кислоты в промышленности используют метод окисления аммиака.
Общее описание
Формула азотной кислоты: HNO3. Это сильная бесцветная кислота с резким запахом. Он бесконечно растворим в воде. Имеет низкие температуры плавления (-41°С) и температуры кипения (82,6°С). Плотность кислоты 1,52 г/см3.

Концентрированная азотная кислота выделяет токсичные газы – оксиды азота. Азотная кислота окисляет органические вещества: разрушает бумагу, натуральную ткань и вызывает ожоги кожи.
Азотная кислота в небольшом количестве образуется в дождевой воде при разрядах молнии.
Получение
Азотную кислоту впервые получили алхимики из селитры и сернокислого железа в ходе термической реакции:
В современной химии существуют лабораторные и промышленные методы получения азотной кислоты. В лабораториях кислоту получают путем нагревания смеси нитратов и концентрированной серной кислоты:
В промышленности азотную кислоту получают окислением аммиака. Способ осуществляется в три этапа.
Сначала аммиак окисляется на платиновых катализаторах до оксида азота (II):
Эта реакция необратима.
Оксид или монооксид азота (II) окисляется до диоксида или оксида азота (IV):
Последняя стадия — поглощение диоксида азота водой в избытке кислорода:
Все реакции протекают с выделением тепла, т е являются экзотермическими. Последние две реакции обратимы, поэтому конечная концентрация чистой азотной кислоты невелика (45-58 %).
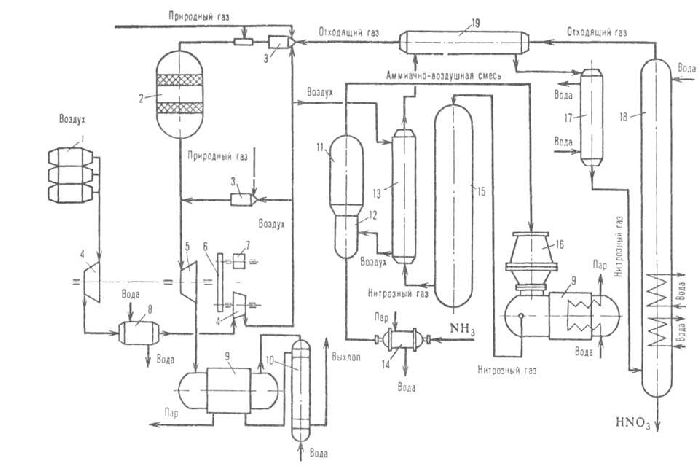
Для увеличения концентрации при реакции оксида азота (IV) с водой равновесие смещается, что увеличивает давление. Также разбавленную азотную кислоту можно смешать с серной кислотой и нагреть. Азотная кислота испаряется и конденсируется.
Лабораторный метод получения азотной кислоты обнаружил немецкий алхимик Иоганн Рудольф Глаубер в XVII веке.

Применение
Азотную кислоту применяют:
- в производстве удобрений;
- в производстве взрывчатых веществ;
- как окислитель ракетного топлива;
- для травления печатных форм в типографиях;
- в производстве красок и лаков;
- в производстве лекарств;
- для определения золота в сплавах;
- для производства органических соединений.
Азотная кислота ядовита. При попадании на кожу разрушает белок, оставляя долго заживающие язвы.
Что мы узнали?
Азотную кислоту производят промышленным и лабораторным способом. В промышленности используется метод окисления аммиака, включающий три реакции. Первым окисляется аммиак, затем оксид азота (II). Последняя реакция – поглощение диоксида азота водой. Для увеличения концентрации в обратимых реакциях давление повышают. В лабораториях кислоту получают действием серной кислоты на нитраты. Азотная кислота используется в промышленности для производства удобрений, взрывчатых веществ, лекарств и красок.








Комментирование закрыто