
Аммиак (NH3) – соединение азота и водорода. Это легкий газ с резким запахом. Производство аммиака в промышленности и лабораториях необходимо для производства удобрений, полимеров, азотной кислоты и других веществ.
В промышленности
Аммиак получают в промышленности из азота путем соединения его с водородом. Азот берется из воздуха, водород из воды. Впервые метод разработал немецкий химик Фриц Габер. Промышленный метод получения аммиака получил название процесса Габера.
Реакция протекает с уменьшением объема и выделением энергии в виде тепла:
Реакция обратима, поэтому необходимо соблюдение нескольких условий. При высоком давлении и низких температурах объем образующегося аммиака увеличивается. Однако низкие температуры снижают скорость реакции, а повышение температуры увеличивает скорость обратной реакции.
Экспериментально были найдены необходимые условия для проведения реакции:
- температура – 500°С;
- давление – 350 атм;
- катализатор – оксид железа Fe3O4 (магнетит) со смесями оксидов серебра, калия, кальция и других веществ.
В этих условиях образующийся газ содержит 30% аммиака. Чтобы избежать обратной реакции, вещество быстро охлаждают. При низких температурах образующийся газ превращается в жидкость. Неиспользованные газы – азот и водород – возвращаются в колонну синтеза. Этот метод помогает быстро получить большое количество аммиака, максимально используя сырье.
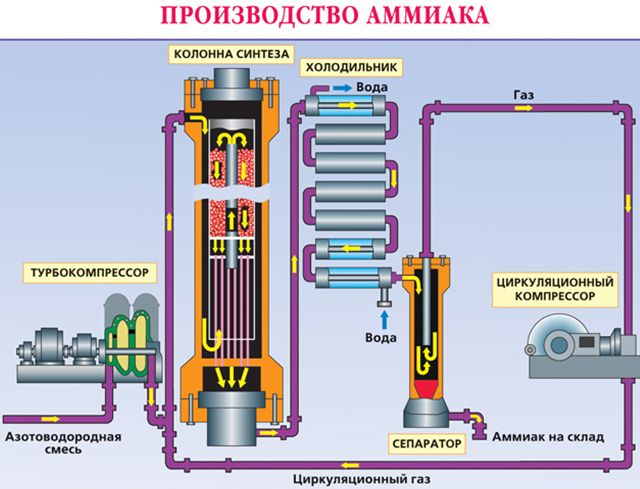
Чтобы найти нужный катализатор, было испробовано 20 тысяч разных веществ.
В лаборатории
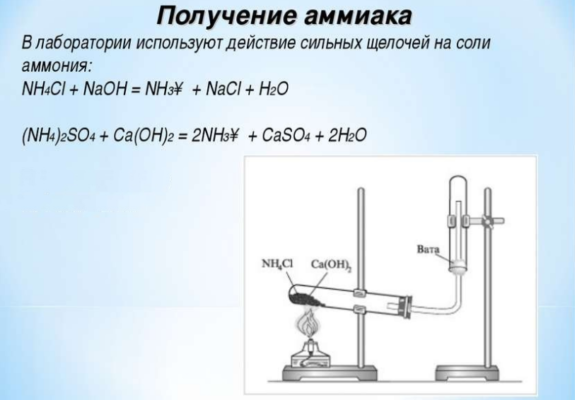
Для получения аммиака в лаборатории применяют реакцию щелочей с солями аммония:
Аммиак также можно получить в лаборатории из хлорида аммония, нагретого вместе с гашеной известью, или путем разложения гидроксида аммония:
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O;
- NH4OH ↔ NH3↑ + H2O.
Полностью осушить аммиак можно с помощью смеси извести и гидроксида натрия, через которую пропускают образовавшийся газ. С этой же целью жидкий аммиак смешивают с металлическим натрием и подвергают перегонке.
Аммиак легче воздуха, поэтому для его сбора пробирку держат вверх дном.
Применение
Аммиак применяется в различных отраслях промышленности:
- в сельском хозяйстве – для производства азотных удобрений;
- в промышленности — для производства полимеров, взрывчатых веществ, искусственного льда;
- в химии — для производства азотной кислоты, соды;
- в медицине – как аммиак.

Что мы узнали?
Аммиак производят промышленно и в лабораторных условиях. Для производства в промышленных масштабах используются азот и водород. Смешиваясь под высокой температурой, давлением и под действием катализатора, простые вещества образуют аммиак. Чтобы реакция не пошла в противоположном направлении при высоких температурах, газ охлаждают. В лаборатории аммиак получают взаимодействием солей аммония со щелочами, гашеной известью или расщеплением гидроксида аммония. Аммиак используется в химической промышленности, сельском хозяйстве, медицине и химии.








Комментирование закрыто