
Для измерения массы атома используется относительная атомная масса, которая выражается в атомных единицах массы (а.е.м.). Относительная молекулярная масса состоит из относительных атомных масс веществ.
Понятия
Чтобы понять, что такое относительная атомная масса в химии, следует понимать, что абсолютная масса атома слишком мала, чтобы ее можно было выразить в граммах, а тем более в килограммах. Поэтому в современной химии за атомную единицу массы (а.е.м.) принимается 1/12 массы углерода. Относительная атомная масса равна отношению абсолютной массы к 1/12 абсолютной массы углерода. Другими словами, относительная масса отражает, во сколько раз масса атома конкретного вещества превышает 1/12 массы атома углерода. Например, относительная масса азота равна 14, т.е в атоме азота содержится 14 эм или в 14 раз больше, чем 1/12 атома углерода.

Среди всех элементов водород самый лёгкий, его масса равна 1 единице. Самые тяжёлые атомы имеют массу в 300 а е м.
Молекулярная масса — это величина, указывающая, во сколько раз масса молекулы превышает 1/12 массы углерода. Также выражается в эм. Масса молекулы состоит из массы атомов, поэтому для расчета относительной молекулярной массы необходимо сложить массы атомов вещества. Например, относительная молекулярная масса воды равна 18. Эта величина представляет собой сумму относительных атомных масс двух атомов водорода (2) и одного атома кислорода (16).

Как видите, эти два понятия имеют несколько общих характеристик:
- относительные атомные и молекулярные массы вещества являются безразмерными величинами;
- относительная атомная масса обозначается Ar, молекулярная масса Mr;
- единица измерения в обоих случаях одинаковая – шпийд.
Молярная и молекулярная массы совпадают численно, но отличаются по размерности. Молярная масса – это отношение массы вещества к количеству молей. Она отражает массу одного моля, который равен числу Авогадро, т.е. 6,02 ⋅ 1023. Например, 1 моль воды весит 18 г/моль, а Mr(Н2О) = 18 а е м. (тяжелее в 18 раз одной атомной единицы массы).
Как рассчитать
Чтобы выразить относительную атомную массу математически, следует определить, что 1/2 части углерода или одна атомная единица массы равна 1,66⋅10−24 г. Следовательно, формула относительной атомной массы имеет следующий вид:
где ma — абсолютная атомная масса вещества.
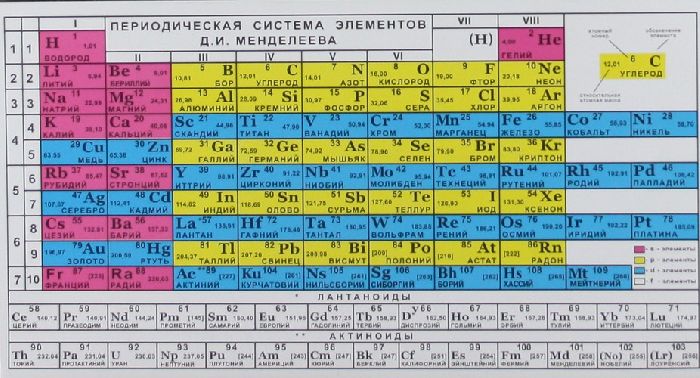
Относительная атомная масса химических элементов приведена в таблице Менделеева, поэтому ее не нужно рассчитывать самостоятельно при решении задач. Относительные атомные массы обычно округляются до целых чисел. Исключение составляет хлор. Масса атомов 35,5.
Следует отметить, что при расчете относительной атомной массы элементов, имеющих изотопы, учитывается среднее значение. Атомная масса в этом случае рассчитывается следующим образом:
где Ar,i — относительная атомная масса изотопов, ni — содержание изотопов в природных смесях.
Например, кислород имеет три изотопа – 16О, 17О, 18О. Их относительная масса 15,995, 16,999, 17,999, а содержание природных смесей 99,759%, 0,037%, 0,204% соответственно. Разделив проценты на 100 и подставив значения, получим:
Обратившись к таблице Менделеева, нетрудно найти это значение в кислородной ячейке.
Относительная молекулярная масса – это сумма масс атомов вещества:
При определении значения относительной молекулярной массы учитывают индексы символов. Например, расчет массы H2CO3 выглядит следующим образом:
Зная относительную молекулярную массу, можно вычислить относительную плотность одного газа по второму, т.е определить, во сколько раз одно газообразное вещество тяжелее второго. Для этого используется уравнение D(y)x = Mr(х) / Mr(y).
Что мы узнали?
На уроке в 8 классе мы узнали об относительной атомной и молекулярной массе. За единицу относительной атомной массы принята 1/12 массы углерода, равная 1,66⋅10−24 г. Для расчета массы необходимо абсолютную атомную массу вещества разделить на атомную единицу массы. (аму). Значение относительной атомной массы указано в таблице Менделеева в каждой ячейке элемента. Молекулярная масса вещества представляет собой сумму относительных атомных масс элементов.








Комментирование закрыто