
Оксиды – сложные вещества, состоящие из двух элементов, один из которых – кислород. Оксиды могут быть солеобразующими и несолеобразующими: одним из видов солеобразующих оксидов являются основные оксиды. Чем они отличаются от других видов и каковы их химические свойства?
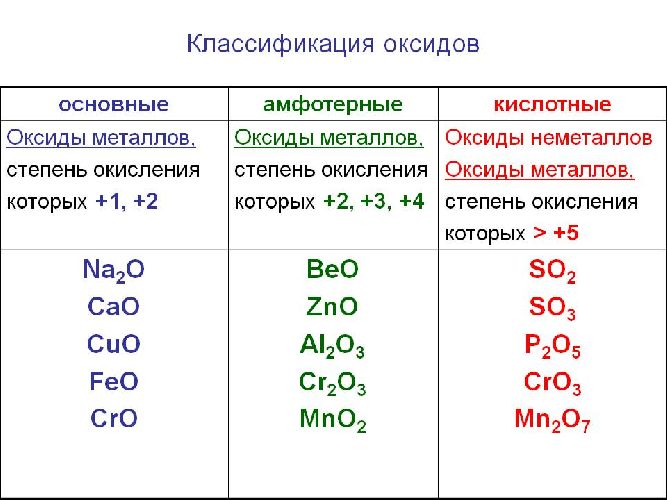
Классификация оксидов
Солеобразующие оксиды делятся на основные, кислотные и амфотерные оксиды. Если основные оксиды соответствуют основаниям, то кислые – кислотам, а амфотерные оксиды соответствуют амфотерным образованиям. Амфотерными оксидами называют соединения, которые в зависимости от условий могут проявлять как основные, так и кислотные свойства.
Физические свойства оксидов весьма разнообразны. Это могут быть газы (CO2), твердые вещества (Fe2O3) или жидкости (H2O). В то же время большинство основных оксидов представляют собой твердые вещества различной окраски.
оксиды, в которых элементы проявляют свою высшую активность называются высшими оксидами. Порядок возрастания кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
Химические свойства основных оксидов
Основные оксиды называются оксидами, которые соответствуют основаниям. Например, основные оксиды K2O, СaO соответствуют основным КОН, Ca(OH)2 .

Основные оксиды образуются типичными металлами, а также металлы переменной валентности в низшей степени окисления (например, CaO, FeO), реагируют с кислотами и кислыми оксидами, образуя при этом соли:
Основные оксиды взаимодействуют также с амфотерными оксидами, в результате чего образуются соли, например:
С водой реагируют только оксиды щелочных и щелочноземельных металлов:
Многие основные оксиды имеют характер восстановления до веществ, состоящих из атомов одного химического элемента:
При нагревании разлагаются только оксиды ртути и благородных металлов:

Список основных оксидов:
| Название оксида | Химическая формула | Характеристики |
| Оксид кальций | СаО | необожженная известь, белое кристаллическое вещество |
| Оксид магния | MgO | белое вещество, малорастворимое в воде |
| Оксид бария | БаО | бесцветные кристаллы с кубической решеткой |
| Оксид меди II | CuO | вещество черного цвета, практически нерастворимое в воде |
| Оксид ртути II | HgO | твердое вещество красного или желто-оранжевого цвета |
| Оксид калия | К2О | бесцветное или бледно-желтое вещество |
| Оксид натрия | Na2O | вещество, состоящее из бесцветных кристаллов |
| Оксид лития | Ли2О | вещество, состоящее из бесцветных кристаллов, имеющих кубическую структуру решетки |
В главных подгруппах периодической системы при переходе от одного элемента к другому сверху вниз наблюдается усиление основных свойств оксидов
Что мы узнали?
При образовании основных оксидов кислород является одним из важнейших элементов.Основные оксиды обладают рядом физических и химических свойств, таких как взаимодействие с водой, кислотами и другими оксидами.








Комментирование закрыто