
Одним из классов сложных неорганических веществ являются основания. Это соединения, в состав которых входят атомы металлов и гидроксильная группа, которая может отщепляться при взаимодействии с другими веществами.
Строение
Основания могут содержать одну или несколько гидроксогрупп. Общая формула оснований Me(OH)x. Атом металла всегда один, а количество гидроксильных групп зависит от валентности металла. При этом валентность ОН-группы всегда равна I. Например, в соединении NaOH валентность натрия равна I, следовательно, это гидроксильная группа. У основания Mg(OH)2 валентность магния II, Al(OH)3 — валентность алюминия III.
Число гидроксильных групп может варьировать в соединениях с металлами переменной валентности. Например Fe(OH)2 и Fe(OH)3. В таких случаях валентность указывается в скобках после названия — гидроксид железа(II), гидроксид железа(III).
Физические свойства
Свойства и активность основания зависят от металла. Большинство основ представляют собой белые твердые вещества без запаха. Однако некоторые металлы придают веществу характерный цвет. Например, CuOH — желтый, Ni(OH)2 — светло-зеленый, Fe(OH)3 — красновато-коричневый.

Виды
Базы классифицируются по двум критериям:
- по количеству ОН-групп – однокислотные и поликислотные;
- по растворимости в воде — щелочи (растворимые) и нерастворимые.
Щелочи образуются из щелочных металлов – лития (Li), натрия (Na), калия (K), рубидия (Rb) и цезия (Cs). Кроме того, к активным металлам, образующим щелочи, относятся щелочноземельные металлы — кальций (Са), стронций (Sr) и барий (Ва). Эти элементы образуют следующие основы:
- ЛиОН;
- NaOH;
- КОН;
- RbOH;
- CsOH;
- Са(ОН)2;
- Sr(OH) 2;
- Ва(ОН)2.
Все остальные основания, например Mg(OH)2, Cu(OH)2, Al(OH)3, относятся к нерастворимым.
По-другому щелочи называют сильными основаниями, а нерастворимые щелочи — слабыми основаниями. При электролитической диссоциации щелочи быстро отдают гидроксильную группу и быстрее реагируют с другими веществами. Нерастворимые или слабые основания менее активны, поскольку не отдают гидроксильную группу.
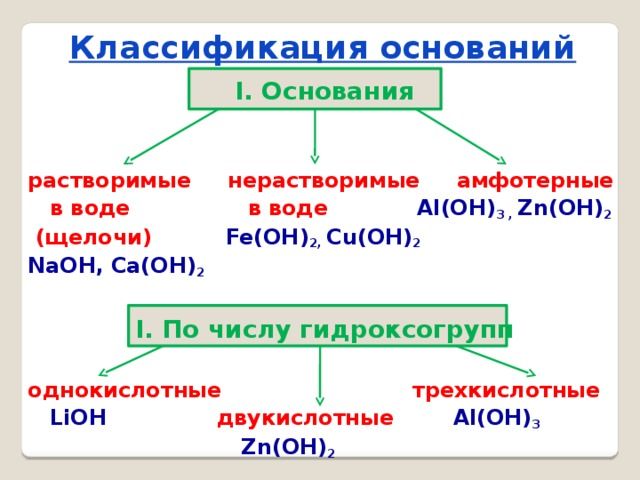
Особое место в систематизации неорганических веществ занимают амфотерные гидроксиды. Они взаимодействуют и с кислотами, и с основаниями, т.е в зависимости от условий ведут себя как щёлочь или как кислота. К ним относятся Zn(OH)2, Al(OH)3, Pb(OH)2, Cr(OH)3, Be(OH)2 и другие основания.
Получение
Базы получают разными способами. Самым простым является взаимодействие металла и воды:
Щелочи получают реакцией оксида с водой:
Нерастворимые основания получаются в результате взаимодействия щелочей и солей:
Химические свойства
Важнейшие химические свойства оснований описаны в таблице.
|
Реакции |
Что образуется |
Примеры |
|
С кислотами |
Соль и вода. Нерастворимые основания реагируют только с растворимыми кислотами |
Cu(OH)2↓ + H2SO4 → CuSO4 +2H2O |
|
Высокотемпературное разложение |
Оксид металла и вода |
2Fe(OH)3 → Fe2O3 + 3H2O |
|
С кислотными оксидами (щелочная реакция) |
Соль |
NaOH + CO2 → NaHCO3 |
|
С неметаллами (входят щелочи) |
Соль и водород |
2NaOH + Si + H2O → Na2SiO3 +H2↑ |
|
Заменить солями |
Гидроксид и соль |
Ba(OH)2 + Na2SO4 → 2NaOH + BaSO4↓ |
|
Щелочи с некоторыми металлами |
Комплексная соль и водород |
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ |
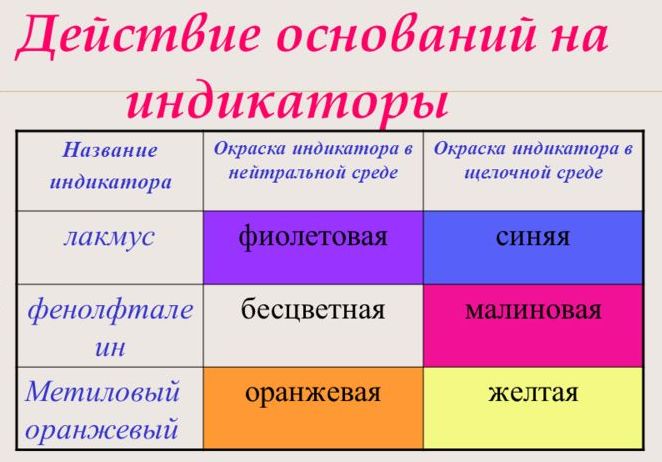
С помощью индикатора проводится тест на определение класса основания. При взаимодействии с основанием лакмус становится синим, фенолфталеин – малиновым, метилоранж – жёлтым.
Что мы узнали?
На уроке химии в 8 классе мы узнали о свойствах, классификации и взаимодействии оснований с другими веществами. Основания – сложные вещества, состоящие из металла и гидроксильной группы ОН. Их делят на растворимые или щелочные и нерастворимые. Щелочи – это более агрессивные основания, которые быстро реагируют с другими веществами. Основания получают путем взаимодействия металла или оксида металла с водой, а также путем взаимодействия соли и щелочи. Основания реагируют с кислотами, оксидами, солями, металлами и неметаллами, а также разрушаются при высоких температурах.








Комментирование закрыто