
Кремний обладает переменной валентностью (II, IV), поэтому может образовывать два оксида кремния – монооксид и диоксид. Они различаются по физическим и химическим свойствам. Подробнее об оксидах кремния мы поговорим в этой статье.
Монооксид
Формула оксида кремния (II) — SiO. Это вязкое, смолоподобное вещество. Сохраняет аморфное состояние и не окисляется в обычных условиях. Не образует солей и не проводит электричество.

Моноксид получают двумя способами:
- нагрев (температура выше 400°С) кремния при недостатке кислорода:
2Si + O2 → 2SiO;
- метод Чохральского для восстановления диоксида углерода при высоких температурах:
SiO2 + Si → 2SiO.
В твердом состоянии монооксид представляет собой темно-коричневый порошок. Проявляет силу и медлительность в реакциях с кислотами. Растворим в плавиковой кислоте.
Химические свойства монооксида кремния:
- разрушается при нагревании:
2SiO → 2Si + O2;
- реагирует с водяным паром при нагревании до 500°С:
SiO + H2O → SiO2 + H2;
- взаимодействует с углекислым газом при нагревании:
SiO + CO2 → SiO2 + CO;
- реагирует с хлором при температуре 800°С, образуя жидкий хлорид кремния:
2SiO + 4Cl2 → 2SiCl4 + O2.
Монооксид не встречается на Земле в естественной среде. Однако газообразный монооксид входит в состав межзвёздных пылевых облаков.
Диоксид
Оксид кремния (IV) – SiO2. Это твердое кристаллическое тугоплавкое вещество, нерастворимое в воде. Не проводит электричество.
Формула диоксида содержится в песке, кварце, горном хрустале, яшме, агате, аметисте и других горных породах. Диоксид составляет 87% литосферы.

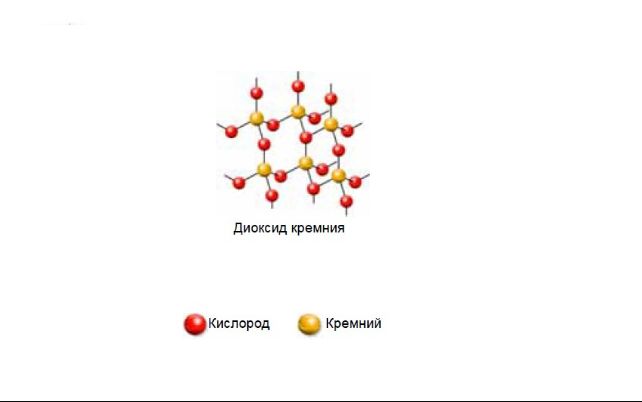
Диоксид кремния имеет немолекулярную структуру. Кристаллическая решетка состоит из атомов кремния и кислорода, соединенных ковалентными связями. К каждому атому кремния присоединены четыре атома кислорода, а к каждому атому кислорода присоединены два атома кремния.
Диоксид можно получить в лаборатории нагреванием кремния до 400-500°С в присутствии кислорода:
Диоксид образуется при действии кислот на растворимые силикаты. В результате образовавшаяся кремниевая кислота распадается на воду и диоксид:
- Na2SiO3 + 2CH3COOH → 2CH3COONa + H2SiO3↓;
- H2SiO3 → H2O + SiO2.
В обычных условиях он реагирует только с плавиковой кислотой. Реагирует со щелочами и основными оксидами при нагревании. Не реагирует с водой. Основные свойства с химическими уравнениями представлены в таблице.
|
Взаимодействие |
Описание |
Уравнение |
|
С неметаллами |
Реагирует с водородом и углеродом с образованием кремния и карборунда соответственно |
– SiO2 + 2H2 → Si + 2H2O; – SiO2 + 3С → SiC + 2CO |
|
С активными металлами |
Реагирует при температуре выше 1000°C с образованием кремния. При избытке металла образуются силициды |
– SiO2 + 2Mg → Si + 2MgO; – SiO2 + 4Mg → Mg2Si + 2MgO |
|
С фтористым водородом |
Реагирует с газом и плавиковой кислотой при нормальных условиях |
– SiO2 + 4HF → SiF4 + 2H2O; – SiO2 + 6HF → H2[SiF6] + 2H2O |
|
Со щелочами |
Предохранители с образованием силикатов |
SiO2 + 4NaOH → Na4SiO4 + 2H2O |
|
С оксидами |
Реагирует при высоких температурах |
SiO2 + MgO → MgSiO3 |
|
С карбонатами щелочных металлов |
Реагирует при нагревании |
SiO2 + K2CO3 → K2SiO3 + CO2 |
Диоксид кремния используется для производства стекла, силикагеля, бетона.
Что мы узнали?
Кремний образует два оксида — монооксид и диоксид. Моноксид – аморфное вещество, не образующее соли. При нагревании он взаимодействует с водяным паром, углекислым газом и хлором. При нагревании распадается на простые вещества. Диоксид-песок и его производные. Это кристаллическое вещество немолекулярной структуры. Не реагирует с водой и кислотами (за исключением плавиковой кислоты). Взаимодействует с неметаллами, металлами, фтороводородом, щелочами, оксидами, карбонатами. Оксиды кремния являются диэлектрическими веществами.








Комментирование закрыто