
Негашеная известь – это оксид кальция. Его получают в лабораториях и промышленным способом из природного сырья. Вещество активно используется в строительстве и промышленности.
Физические свойства
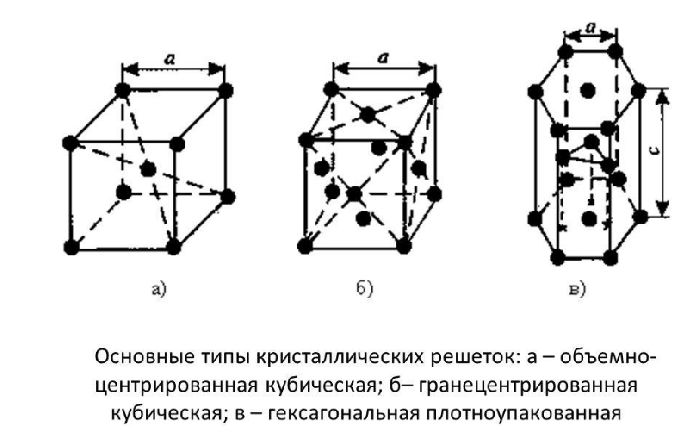
Оксид кальция — неорганическое кристаллическое вещество в виде белого или почти белого порошка, без запаха и вкуса. Твердое вещество кристаллизуется в кубические гранецентрированные кристаллические решетки в виде хлорида натрия (NaCl).
Общее описание вещества представлено в таблице.
|
В разводе |
Важность |
|
Формула соединения оксида кальция |
СаО |
|
Температура плавления |
2627°С |
|
Температура кипения |
2850°С |
|
Растворимость |
В глицерине. Нерастворим в этаноле, с водой образует гидроксид |
|
Молярная масса |
56,077 г/моль |
|
Плотность |
3,37 г/см3 |
|
Химическая связь в кристалле |
Ионный |
Оксид кальция – едкое вещество, относящееся ко второму классу опасности. Агрессивные свойства проявляет при взаимодействии с водой, образуя гашёную известь.

Получение
Оксид кальция еще называют негашеной известью из-за способа производства. Негашеную известь получают путем нагревания и разрушения известняка – карбоната кальция (CaCO3). Это природное вещество, встречающееся в виде минералов – арагонита, ватерита, кальцита. Входит в состав мрамора, мела, известняка.
Реакция получения оксида кальция из известняка выглядит следующим образом:
Кроме того, негашеную известь можно получить двумя способами:
- из простых веществ создают на металле оксидный слой –
2Са + О2 → 2СаО;
- при термической обработке гидроксида или солей кальция –
Са(ОН)2 -> СаО + Н2О; 2Ca(NO3)2 → 2CaO + 4NO2 + O2.
Реакции протекают при высоких температурах. Температура сожжения известняка – 900-1200°C. При 200-300°C на поверхности металла начинает образовываться оксид. Для разложения солей и гидроксида необходима температура в 500-600°C.
Химические свойства
Оксид кальция является высшим оксидом и обладает максимальными окислительными свойствами. Соединения взаимодействуют с неорганическими веществами и свободными галогенами. Важнейшие химические свойства оксида приведены в таблице.
|
Реакции |
Что образуется |
Молекулярное уравнение |
|
С водой |
Образуется гидроксид (гашеная известь). Реакция протекает бурно с выделением тепла |
СаО + Н2О → Са(ОН)2 |
|
С кислотами |
Растворяется с образованием солей |
СаО + 2 HCl → CaCl2 + H2O |
|
С оксидами неметаллов (кислотными остатками) |
Соли образуются |
СаО + SO2 → CaSO3 |
|
С углеродом при нагреве |
Карбид кальция образуется |
СаО + 3С → СаС2 + СО |
|
С алюминием |
Восстанавливает кальций. Оксид алюминия образуется |
3CaO + 2Al → Ca + Al2O3 |
Применение
Оксид используется в пищевой промышленности как:
- улучшитель муки и хлеба;
- пищевая добавка Е529;
- регулятор кислотности;
- питательная среда для дрожжей;
- катализатор гидрирования (добавления водорода) жиров.
Кроме того, негашеную известь применяют в химической промышленности и строительной отрасли для производства различных веществ:
- масла;
- стеарат кальция;
- толстый;
- огнезащитные материалы;
- штукатурка;
- высокоглиноземистый цемент;
- известковый песчаник.

Что мы узнали?
Оксид кальция или негашеная известь представляет собой кристаллическое вещество, которое бурно реагирует с водой с образованием гашеной извести. Широко используется в промышленности, особенно пищевой и строительной. Зарегистрировано как пищевая добавка Е529. Он имеет высокие температуры плавления и кипения и растворим только в глицерине. Образуется при сжигании карбоната кальция. Он проявляет окислительные свойства, образует соли с оксидами и кислотами, взаимодействует с углеродом и алюминием.








Комментирование закрыто