
Известно десять оксидов азота, пять из которых находятся в стабильном состоянии. Атомы кислорода и азота во всех оксидах связаны ковалентной полярной химической связью.
Общее описание
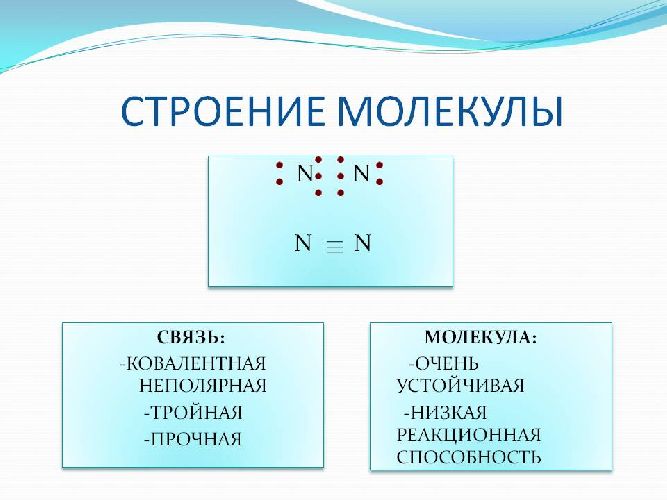
Азот – бесцветный двухатомный газ (N2). Атомы в молекуле азота имеют прочную тройную связь, что обусловливает инертность элемента. Азот вступает в реакцию с другими элементами и соединениями под действием внешних факторов – высокой температуры, электричества, катализаторов.
Оксиды образуются из солей аммония и азотной кислоты. Формулы оксидов азота и краткие характеристики соединений приведены в таблице.
|
Название |
Формула |
Получающий |
Функции |
|
Оксид диазота или оксид азота (I) – «счастливый газ» |
Н2О |
– Нагревание нитрата аммиака (опасность газа): NH4NO3 → N2O + 2H2O; – нагревание аминосульфокислоты с разбавленной азотной кислотой: NH2SO2OH + HNO3 → N2O + H2SO4 + H2O |
Бесцветный газ со сладким вкусом. Не горит, токсичен. Растворим в воде, серной кислоте, спирте |
|
Моноксид или оксид азота (II |
НЕТ |
Единственный оксид, получаемый прямым взаимодействием кислорода и азота при температуре 1200°С или при электрических разрядах: N2 + O2 → 2NO |
Бесцветный ядовитый газ. На воздухе окисляется, становясь коричневым. Трудно разжижать. В жидком виде имеет синий цвет |
|
Триоксид диазота или оксид азота (III |
N2O3 |
При взаимодействии разбавленной азотной кислоты и твердого оксида мышьяка с последующим охлаждением: – 2HNO3 + As2O3 → NO2 + NO + 2HAsO3; – NO2 + NO → N2O3 |
При нормальных условиях – голубая жидкость. Он может приобретать газообразное и твердое состояния. Сильно токсичен, вызывает ожоги кожи |
|
Диоксид азота (IV) |
NO2 |
– При взаимодействии оксида азота и меди: Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O; – при разложении нитрата свинца: 2Pb(NO3)2 → 2PbO + 4NO2 + O2 |
Ядовитый газ коричневого цвета с резким запахом. Легко разжижается при температуре ниже +21°С, превращаясь в желтую жидкость |
|
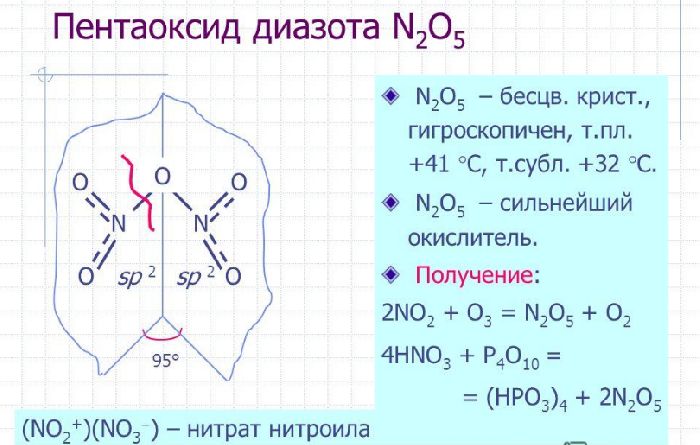
Пентаоксид диазота или оксид азота (V) |
N2O5 |
– Дегидратация азотной кислоты в присутствии оксида люминофора: 2HNO3 + P2O5 → 2HPO3 + N2O5; – взаимодействие хлора и нитрата серебра: 4AgNO3 + 2Cl2 → 4AgCl + 2N2O5 + O2; – реакция оксида азота (IV) и озона: 2NO2 + O3 → N2O5 + O2 |
Бесцветное твердое кристаллическое соединение, крайне нестабильное при нормальных условиях. Стабильную форму приобретает при температуре ниже +10°С |

Помимо пяти стабильных оксидов азота известны ещё пять нестабильных соединений – NON3, NO2N3, N(NO2)3, нитратный радикал NO3 и димер, состоящий из двух простых молекул, диоксида азота (N2O4).
Химические свойства
Основные реакции оксидов азота с простыми и сложными веществами представлены в таблице.
|
Оксиды |
Реакции |
Уравнения |
|
Н2О |
При гревании разлагается. Окисляет неметаллы. Проявляет сивышение востановителя с сильными окислителями. Реагирует с аммиаком и его производными. Он образует солей. Не реагирует с водой, щелочами, кислотами |
– 2N2O → 2N2 + O2; – 2N2O + C → 2N2 + CO2; – 5N2O + 8KMnO4 + 7H2SO4 → 5Mn(NO3)2 + 3MnSO4 + 4K2SO4 + 7H2O; – 2NH3 + N2O → NH4N3 + H2O; – 2NaNH2 + N2O → NaN3 + NaOH + NH3 |
|
НЕТ |
В воздухе при нормальных условиях окисляется до диоксида азота. Взаимодействует с галогенами. В присутствии сильного восстановителя проявляются окислительные свойства. Не образует твердое вещество, плохо растворимое в воде |
– 2НО + О2 → 2НО2; – 2NO + Cl2 → 2NOCl; – 2SO2 + 2NO → 2SO3 + N2 |
|
N2O3 |
Разлагается при гревании. Реагирует с водами с образованием азотистой аксити. Растворим в челочках |
– N2O3 → NO + NO2; – N2O3 + H2O → 2HNO2; – N2O3 + 2KOH → 2KNO2 + H2O |
|
NO2 |
Реагирует с неметаллами, металлами, галогенами, водой. Окисляет оксиды серы. Растворяется в челочках |
– 10NO2 + 8P → 4P2O5 + 5N2; – 4NO2 + Zn → Zn(NO3)2 + 2NO; – 2NO2 + 2Cl2 → NOCl + NO2Cl + Cl2O; – 2NO2 + H2O → HNO3 + HNO2; – NO2 + SO2 → SO3 + NO; – 2NO2 + 2KOH → KNO3 + KNO2 + H2O |
|
N2O5 |
Быстро разлагается с вызромом. Растворяется в воде, щелочках |
– 2N2O5 → 4NO2 + O2; – N2O5 + H2O ↔ 2HNO3; – N2O5 + 2NaOH → 2NaNO3 + H2O |
Оксиды используются для получения азотной кислоты. N2O используется в качестве наркоза.
Что мы узнали?
Из темы урока они узнали, что азот может образовывать пять устойчивых оксидов, проявляющих чередующуюся валентность I, II, III, IV, V. Только один оксид (NO) можно получить при непосредственном взаимодействии азота и кислорода при нагревании или под воздействием электричества. Остальные оксиды выделяются из солей аммония и азотной кислоты. Большинство оксидов представляют собой токсичные газы, способные сжижаться. Оксиды реагируют с металлами, неметаллами, щелочами, оксидами.








Комментирование закрыто