
Взаимодействие между веществами, в результате которого изменяются степени окисления элементов, называется окислительно-восстановительной реакцией (ОВР). Такое изменение осуществляется путем перераспределения электронов между акцептором и донором.
Общее описание
Во время ORR происходит обмен атомами. Акцептор или окислитель принимает электроны, а донор или восстановитель отдает электроны. Получается, что акцептор восстанавливается (приобретает недостающие электроны), а донор окисляется (теряет электроны). Эти процессы происходят одновременно и зависят друг от друга.
Обмен электронами происходит на внешнем энергетическом уровне. В результате возникают ковалентные связи.
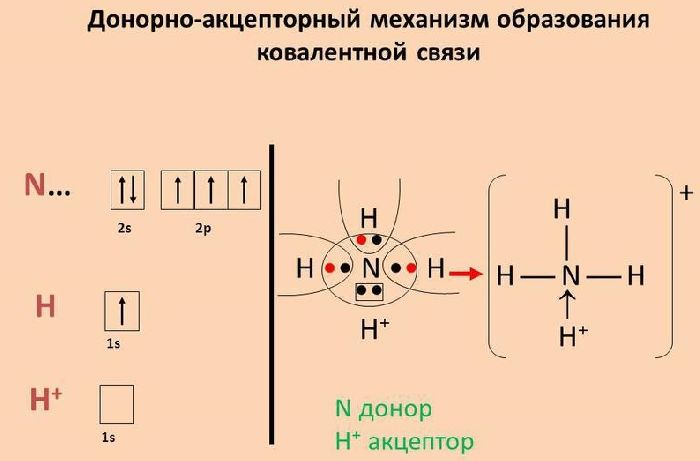
Степень окисления – это условный заряд атома, который указывает на степень окисления конкретного атома. Это значение не отражает истинный заряд атома и используется для облегчения написания и расчета уравнения.
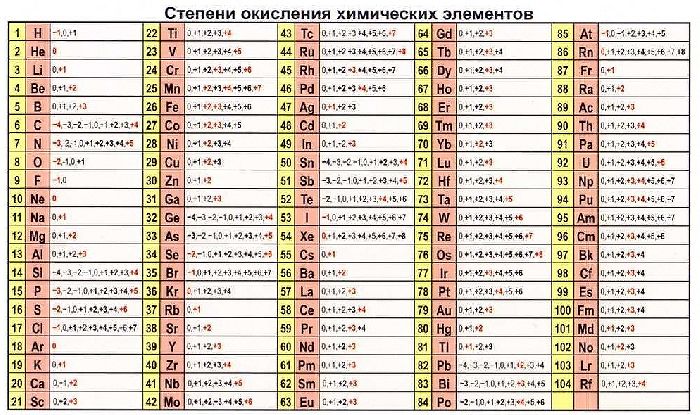
Степень окисления указывается цифрой над элементом. Знаки плюс и минус указывают, является ли элемент восстановителем (+) или окислителем (-). Простые вещества, свободные элементы, всегда имеют «нулевую» степень окисления.
Примеры окислительно-восстановительных реакций:
- 2Mg0 + O20 → 2Mg+2O-2 (магний отдал два электрона, кислород принял);
- Н2О + F2O -> 2H+1F-1;
- 2Na0 + Cl20 → 2Na+1 Cl-1;
- Cu+2S+6O4-2 + Fe0 → Fe+2S+6O4-2 + Cu0.
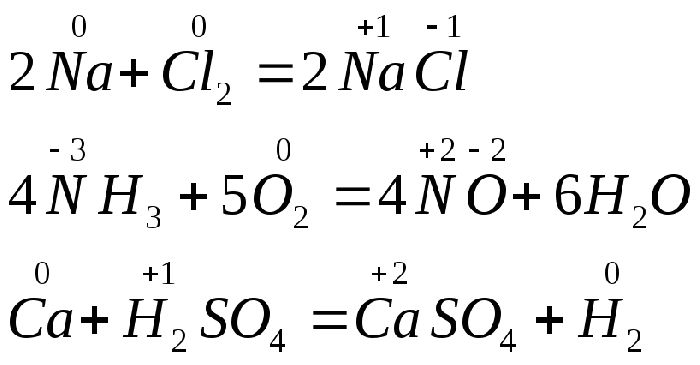
Все металлы являются восстановителями. Они охотно отдают внешние электроны и активно реагируют с неметаллами. Элементы с неметаллическими свойствами могут действовать как восстановитель и окислитель в зависимости от реакции. Узнать значение можно в специальной таблице.
Степень окисления акцептора в процессе ОВР увеличивается, степень донора – уменьшается.
Классификация
Существует четыре типа OVR:
- межмолекулярные – атомы-окислители и восстановители встречаются в молекулах разных веществ:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O;
- внутримолекулярный – атомы окислителя и восстановителя входят в состав одного и того же вещества:
2KClO3 = 2KCl + 3O2;
- диспропорционирование или самоокисление-самовосстановление – атом одного и того же элемента выполняет функцию и восстановителя, и окислителя:
4K2SO3 = 3K2SO4 + K2S (в K2SO4 сера – восстановитель, в K2S – окислитель);
- контрпропорционирование – атомы одного элемента в составе исходных веществ имеют разные степени окисления, а последних – одинаковую:
S+4O2 + 2H2S+2 = 3S0 + 2H2O.
Процесс окисления (отдачи электронов) записывают со знаком минус, показывая, сколько электронов получил окислитель: S-2 – 2ē → S0, Al0 – 3ē → Al+3, Fe+2 – ē → Fe+3. Процесс восстановления (присоединения электронов) записывается со знаком плюса: Mn+4 + 2ē → Mn+2, S0 + 2ē → S-2, Cr+6 + 3ē → Cr+3.
Что мы узнали?
На уроке химии в 9 классе мы узнали, что окислительно-восстановительная реакция – это взаимодействие веществ с изменением степени окисления. Эта условная величина указывает, сколько электронов атом принял (со знаком минус) или отдал (со знаком плюс). В результате взаимодействия акцепторов (окислителей) и доноров (восстановителей) возникает ковалентная связь. Различают четыре типа ЧОО: межмолекулярный, внутримолекулярный, диспропорционирование, контрпропорционирование.








Комментирование закрыто