
Альдегиды – органические вещества, обязательно содержащие карбонильную группу –COH. Эти вещества обладают разными химическими свойствами, среди которых важную роль играет окисление. Как происходит окисление альдегидов и какие реакции протекают?
Общая характеристика альдегидов
Названия альдегидов образуются от соответствующих названий предельных углеводородов с суффиксом -ал или используются названия соответствующих исторически сложившихся названий карбоновых кислот. Общая формула альдегидов выглядит следующим образом: CnH2nO
В отличие от спиртов и фенолов для альдегидов не характерно образование водородных связей, поэтому температуры кипения и плавления ниже. К альдегидам относятся такие вещества, как формальдегид, ацетальдегид, акролеин и многие другие. Формальдегид или муравьиный альдегид CH2O — газ с резким запахом. Это вещество необходимо для производства каучука и многих лекарственных веществ ацетальдегида CH3COH. Это вещество бесцветно и используется для получения уксусной кислоты. Акролеин CH2 =CH-COH представляет собой жидкость, которая легко испаряется. Этот альдегид в основном используется для производства лекарств.
Окисление альдегидов
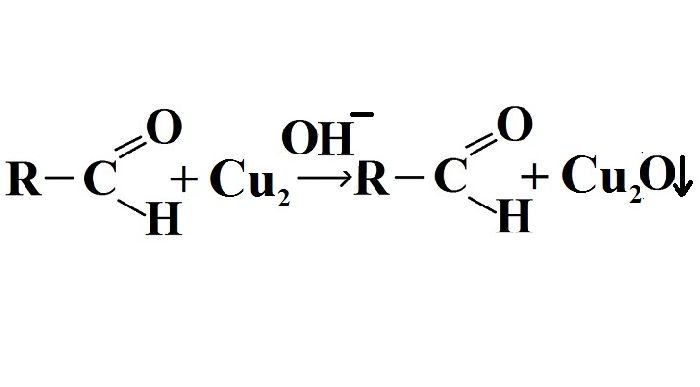
Для альдегидов характерны такие реакции, как присоединение, окисление и образование полимеров. Альдегиды очень легко окисляются, поскольку окисленный атом углерода имеет атом водорода. Качественными реакциями на наличие альдегидной группы являются «реакции серебряного зеркала» и реакция восстановления свежеосажденного гидроксида меди(II) с образованием красно-оранжевого осадка оксида меди(I):
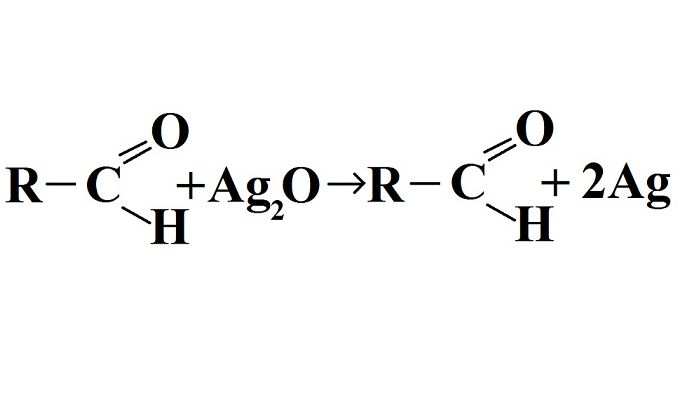
Реакция «серебряного зеркала» – это восстановление гидроксида диамино-серебра или, как часто именуют, оксида серебра. Свое название реакция получила благодаря едва заметному налету, появляющемуся на стенках пробирки в процессе реакции. Температура, при которой происходит реакция, может достигать 80-100 градусов по Цельсию.
Реакция окисления альдегидов гидроксидом меди(II) весьма эффективна. В ходе реакции двухвалентная медь восстанавливается до одновалентной меди в реактиве Фелинга.
Реактив Фелинга – химический реактив, состоящий из раствора соли натрия-калия тартрата и раствора сульфата меди
Окисление альдегидов может происходить и под действием реактива Джонса. При этом методе, в отличие от других, не требуется повышения температуры, и реакция проводится при температуре 0-20 градусов. Реагент состоит из оксида хрома (VI), разбавленного серной кислотой и ацетоном.

Иногда альдегиды могут окисляться йодом в присутствии щелочи, а также диоксидом селена и перманганатом калия.
Что мы узнали?
Альдегиды являются сильными окислителями. Эти соединения способны окисляться в результате реакции Фелинга, «реакции серебряного зеркала», а также под действием реактива Джонса, йода и диоксида селена.








Комментирование закрыто