
Спирты – это производные углеводородов с одной или несколькими гидроксильными группами –ОН (гидроксил). В зависимости от количества -ОН-группы в соединениях различают одно-, ди-, трех- и многоатомные спирты. Рассмотрим одноатомные спирты.
Общее описание
Одноатомные спирты содержат несколько групп -СН- и одну гидроксильную группу -ОН. Одноатомные спирты происходят из предельных углеводородов – алканов. При замене одного атома водорода на группу -ОН образуется насыщенный или насыщенный одноатомный спирт. Следовательно, общая формула одноатомных спиртов — CnH2n+1-OH или CnH2n+2O.
Названия предельных спиртов соответствуют гомологическому ряду алканов с суффиксом «-ол». Например этанол, пропанол, бутанол. Простейший одноатомный спирт – метанол – содержит всего один атом углерода (CH3OH). Это первый представитель гомологического ряда одноатомных спиртов.
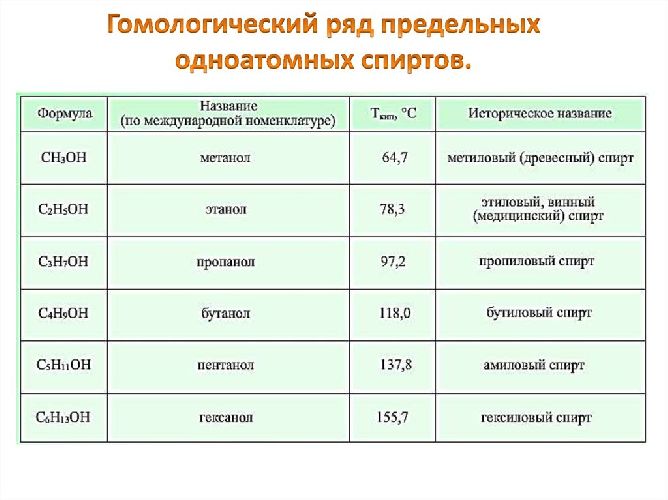
Химические и физические свойства спиртов обусловлены наличием гидроксила – функциональной группы.
Изомерия
Для одноатомных спиртов характерны два типа изомерии:
- структурные – изомерия углеродного скелета и расположение гидроксильной группы;
- интеркласс с эфирами.
Изомерия углеродного скелета характерна для спиртов с четырьмя и более атомами углерода. Например, изомеры бутанола (C4H9OH):
- СН3-СН2-СН2-СН2-ОН – бутанол-1;
- СН3-СН(СН3)-СН2-ОН – 2-метилпропанол-1.
Изомерия в гидроксильном положении характерна для спиртов с тремя и более атомами углерода. Например, когда группа -ОН «смещается» на второй атом углерода в пропаноле-1, образуется пропанол-2:
- СН3-СН2-СН2-ОН – 1-пропанол;
- CH3-CH(OH)-CH3 – 2-пропанол.
В зависимости от положения группы -ОН в молекуле различают три группы предельных спиртов:
- первичный – гидроксил присоединен к первому атому углерода;
- вторичный – ко второму атому углерода присоединен гидроксил;
- третичная – к третьему атому углерода присоединяется гидроксил.
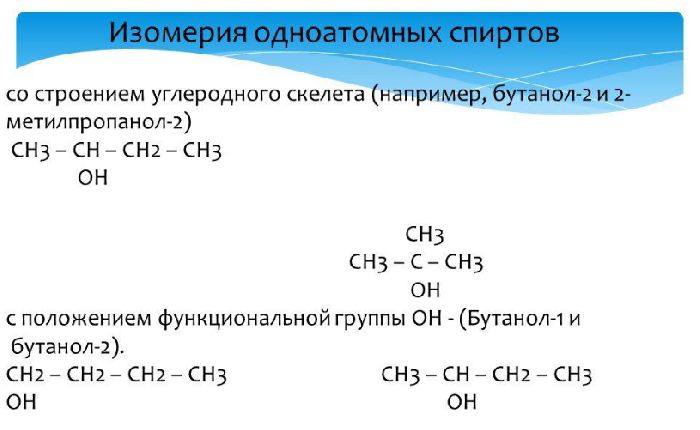
Первая цифра в названии спирта указывает на положение метильной группы -CH3. Второе число показывает, где находится гидроксил.
Получение
Существует несколько способов получения насыщенного спирта:
- гидратация алкенов — присоединение воды:
СН2=СН2 + Н2О → СН3СН2ОН;
- гидролиз алкилгалогенидов в присутствии водных растворов щелочей:
CH3CH2Cl + NaOH → CH3CH2OH + NaCl;
- восстановление альдегидов (образование первичных спиртов):
СН3СНО + Н2 -> СН3-СН2-ОН;
- восстановление кетонов (образование вторичных спиртов):
СН3-С(О)-СН3 + Н2 → СН3-СН(ОН)-СН3;
- ферментация глюкозы (производство этанола):
C6H12O6 → 2C2H5OH + 2CO2↑
.
Свойства
Насыщенные спирты, содержащие не более 15 атомов углерода, — жидкости; более 15 являются твердыми веществами. Метанол, этанол, пропанол-2 хорошо смешиваются с водой. Насыщенные спирты имеют высокие температуры плавления и кипения.
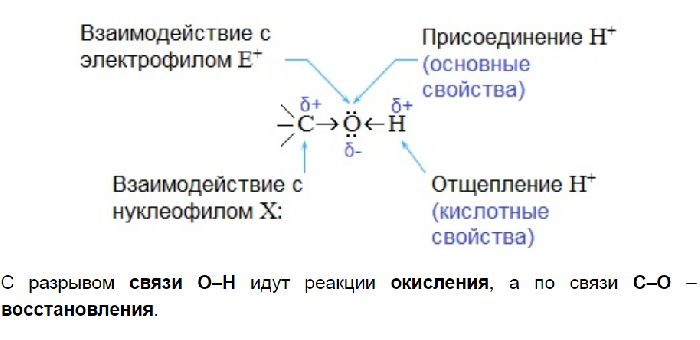
Химические свойства предельных спиртов зависят от типа разрываемой связи. При разрыве связи ОН происходят следующие реакции:
- с щелочными металлами –
2C2H5OH + 2Na → 2C2H5ONa + H2;
- с органическими и неорганическими кислотами (образование сложных эфиров) –
C2H5OH + CH3COOH → CH3COOC2H5;
- окисление в присутствии перманганата или дихромата калия –
2CH3OH + 3O2 → 2CO2 + 4H2O.
Реакции, сопровождающиеся разрывом связей CO:
- дегидратация в присутствии катализатора –
СН3-СН2-СН(ОН)-СН3 -> СН3-СН=СН-СН3 + Н2О;
- замещение гидроксила галогеном –
C2H5OH + HCl → C2H5Cl + H2O.
Насыщенные спирты имеют применение в химической и пищевой промышленности. Из спиртов производят растворители, кислоты, медикаменты, топливо.
Что мы узнали?
На уроке химии в 10 классе мы узнали, что такое одноатомные спирты. Производные углеводородов, содержащие гидроксильную группу, называются насыщенными или насыщенными одноатомными спиртами. Для них характерна межклассовая и структурная изомерия. Одноатомные спирты получают из алкенов, алкилгалогенидов, альдегидов, кетонов и глюкозы. Это активные вещества, которые реагируют с кислородом, активными металлами и кислотами. Используется для производства растворителей, топлива, кислот.








Комментирование закрыто