
Органические соединения, содержащие кратные связи (двойные или тройные), называются ненасыщенными или ненасыщенными углеводородами. О классах ненасыщенных углеводородов и о том, какими свойствами они обладают, мы рассказываем в этой статье.
Классы
К ненасыщенным углеводородам относятся ациклические классы веществ – алкены, алкины, алкадиены. Более подробно о классах ненасыщенных углеводородов рассказано в таблице.
|
Сорт |
Определение |
Общая формула |
Гомологи |
|
Алкены |
Молекулы содержат двойную связь. Названия образуются так же, как названия алканов, но с суффиксом «-ен» |
CnH2n |
|
|
Алкины |
Молекулы содержат тройную связь. Названия соответствуют алканам с суффиксом «-ин» |
CnH2n-2 |
|
|
Алкадиены |
Молекулы содержат две двойные связи. Название соответствует названиям алканов с суффиксом «-диен» |
CnH2n-2 |
|
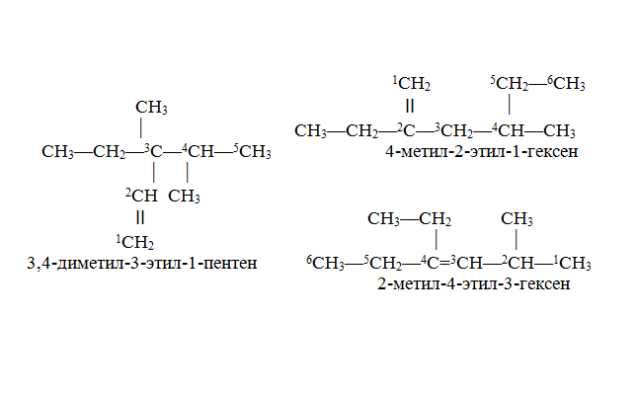
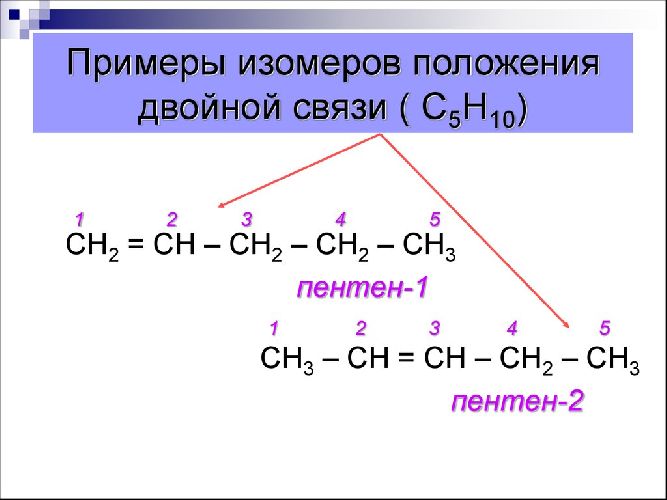
Для ненасыщенных углеводородов характерна изомерия углеродного скелета, положения кратной связи и межклассовая изомерия (алкины с алкадиенами, алкены с циклоалканами). Пример: бутадиену (СН2=СН-СН=СН2) соответствует бутин-1 (СН≡С-СН2-СН3) и бутин-2 (СН3-С≡С-СН3).
Свойства
В зависимости от числа атомов углерода непредельные углеводороды бывают газами (С2-С4), жидкостями (С5-С17), твердыми веществами (С18 и выше). Плотность вещества, температура плавления и кипения увеличиваются с увеличением молекулярной массы.
Ненасыщенные углеводороды более активны, чем насыщенные. Разрывая больше связей в молекулах, ненасыщенные углеводороды могут присоединять дополнительные атомы водорода и становиться насыщенными углеводородами. Также добавляются галогены и галогеноводороды. В таблице описаны важнейшие химические свойства ненасыщенных углеводородов.
|
Реакция |
Алкены |
Алкины |
Алкадиены |
|
Гидрирование |
СН3-СН2-СН=СН2 + H2 → СН3-СН2-СН2-СН3 |
СН3-С≡СН + Н2 → СН3-СН = СН2 + Н2 → СН3-СН2-СН3 |
СН2=СН-СН=СН2 + 2H2 → СН3-СН2-СН2-СН3 |
|
Галогенирование |
CH2=CH2 + Cl2 → Cl-CH2-CH2-Cl |
CH≡CH +Br2 → CHBr=CHBr + Br2 → CHBr2-CHBr2 |
CH2=CH-CH=CH2 + Br2 → CH2(Br)-CH(Br)-CH=CH2 или CH2(Br)-CH=CH-CH2-Br |
|
Добавление галогеноводородов |
CH2=CH2 + HCl → CH3-CH2-Cl |
CH=CH +HCl → CH2=CHCl + HCl → CH3-CHCl2 |
CH2=CH-CH=CH2 +HBr → CH3-CH(Br)-CH=CH2 или CH3-CH=CH-CH2-Br |
|
Полимеризация |
nCH2=CH2 → (-CH2-CH2-)n – полиэтилен |
Тримеризация ацетилена в бензол: 3C2H2 → C6H6 |
nCH2=CH-CH=CH2 -> (-CH2-CH=CH-CH2-)n |
Ненасыщенные углеводороды используют в сварке, в качестве растворителей, для изготовления каучука.

Что мы узнали?
Из урока 9 класса мы узнали, что такое ненасыщенные или ненасыщенные углеводороды. К ним относятся алкены с одной двойной связью, алкины с одной тройной связью и алкадиены с двумя двойными связями. В зависимости от количества связей в молекуле соединения находятся в газообразном, жидком или твердом состоянии. Эти вещества более активны, чем насыщенные углеводороды, за счет разрыва большего количества связей. Они вступают в реакции присоединения и способны полимеризоваться.








Комментирование закрыто