
Сложные вещества, состоящие из атомов водорода и кислотных остатков, называются минеральными или неорганическими кислотами. Кислотные остатки представляют собой оксиды и неметаллы, связанные с водородом. Основное свойство кислоты – способность образовывать соли.
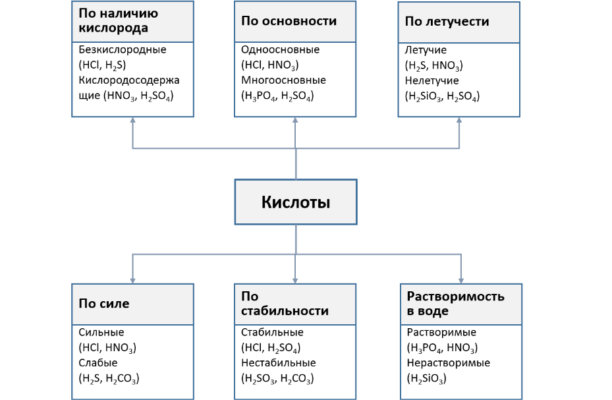
Классификация
Основная формула минеральных кислот – HnAc, где Ac – кислотный остаток. В зависимости от состава кислотного остатка различают два типа кислот:
- кислород, содержащий кислород;
- бескислородный, состоящий только из водорода и неметаллов.
Основной перечень неорганических кислот по типу представлен в таблице.
|
Кончик |
Название |
Формула |
|
Кислород |
Азотная |
ЛЕНТ3 |
|
Азотистая |
HNO2 |
|
|
Борная |
H3BO3 |
|
|
Дихромовая |
H2Cr2O7 |
|
|
Йод |
H5IO6 |
|
|
Ядноватая |
ХИО3 |
|
|
Кремний – метакремний и ортокремний |
H2SiO3 и H4SiO4 |
|
|
Марганцовая |
HMnO4 |
|
|
Марганцовая |
H2MnO4 |
|
|
Метафосфорная |
ГПО3 |
|
|
Мышьяковая |
H3AsO4 |
|
|
Ортофосфорная |
H3PO4 |
|
|
Серная |
H2SO4 |
|
|
Сернистый |
H2SO3 |
|
|
Тиосерная |
H2S2O3 |
|
|
Тетратионовая |
H2S4O6 |
|
|
Угольная |
H2CO3 |
|
|
Фосфористая |
H3PO3 |
|
|
Фосфорноватистая |
H3PO2 |
|
|
Хлорная |
HClO4 |
|
|
Хлорноватая |
HClO3 |
|
|
Хлористая |
HClO2 |
|
|
Хлорноватистая |
HClO |
|
|
Хром |
H2CrO4 |
|
|
Циановая |
НОСН |
|
|
Неоксигенированный |
Фтор |
ВЧ |
|
Соляная (соленая) |
HCl |
|
|
Бромводород |
ХБр |
|
|
Йод |
ПРИВЕТ |
|
|
Сероводород |
H2S |
|
|
Циановодород |
HCN |
В соответствии со свойствами кислот их классифицируют по следующим признакам:
- растворимость: растворимая (HNO3, HCl) и нерастворимая (H2SiO3);
- летучесть: летучие (H2S, HCl) и нелетучие (H2SO4, H3PO4);
- степень диссоциации: сильная (HNO3) и слабая (H2CO3).
Для обозначения минеральных кислот используются традиционные и тривиальные названия. Традиционные названия соответствуют наименованию элемента, который образует кислоту с добавлением морфем -ная, -овая, а также -истая, -новатая, -новатистая для обозначения степени окисления.
Получение
Основные способы получения кислоты представлены в таблице.
|
Метод |
Описание |
Примеры |
|
Взаимодействие прихода стривесть |
Образование бескислородных кислот |
– H2 + Cl2 = 2HCl; – H2 + S = H2S |
|
Взаимодействие оксидов с водами |
Образование кислородных кислот |
SO3 + H2O = H2SO4 |
|
Взаимодействие солей с растоврами искульт |
Перекладное шалых искульт |
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl |
|
Электролиз |
Под действием электричества водные растворы солей образуют сильные кислоты |
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4 |
Свойства
Большинство кислот представляют собой жидкости с кислым вкусом. Вольфрамовая, хромовая, борная и ряд других кислот при обычных условиях находятся в твердом состоянии. Некоторые кислоты (Н2СО3, H2SO3, HClO) существуют только в водном растворе и считаются слабыми кислотами.

Кислоты – активные вещества, которые реагируют:
- с металлами:
Са + 2HCl = CaCl2 + H2;
- с оксидами:
СаО + 2HCl = CaCl2 + H2O;
- на основе:
H2SO4 + 2KOH = K2SO4 + 2H2O;
- с солью:
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O.
Все реакции сопровождаются образованием солей.
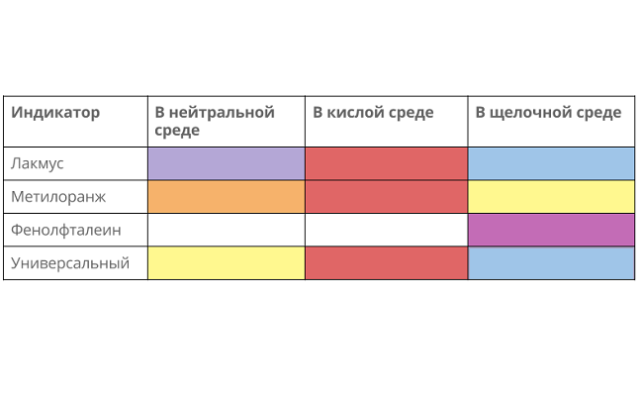
Возможная качественная реакция с изменением цвета индикатора:
- лакмус окрашен в красный цвет;
- метилоранж – розовый;
- фенолфталеин не изменяется.
Химические свойства минеральных кислот определяются способностью диссоциироваться в воде с образованием катионов водорода и анионов водородных остатков. Кислоты, реагирующие с водой необратимо (диссоциируются полностью) называются сильными. К ним относятся хлорная, азотная, серная и хлороводородная.
Что мы узнали?
Неорганические кислоты образуются из остатков водорода и кислот, которые представляют собой атомы или оксиды неметаллов. В зависимости от природы кислотного остатка кислоты классифицируют на бескислородные и кислородсодержащие. Все кислоты имеют кислый вкус и способны диссоциировать в водной среде (диссоциировать на катионы и анионы). Кислоты получают из простых веществ, оксидов, солей. При взаимодействии с металлами оксиды, основания, соли, кислоты образуют соли.








Комментирование закрыто