
Неметаллы – это элементы, обладающие неметаллическими свойствами и занимающие положение в правом верхнем углу таблицы Менделеева. Какова природа неметаллов и чем они отличаются от других соединений, мы узнаем в этой статье.
Общая характеристика
К неметаллическим элементам относятся p-элементы, а также водород и гелий, которые, в свою очередь, относятся к s-элементам. Они расположены правее и выше бор-астатовой диагонали. Всего известно 22 неметалла. У наиболее типичных неметаллов заполнение внешнего уровня электронами близко к максимальному, а радиусы атомов минимальны среди элементов в данный период.
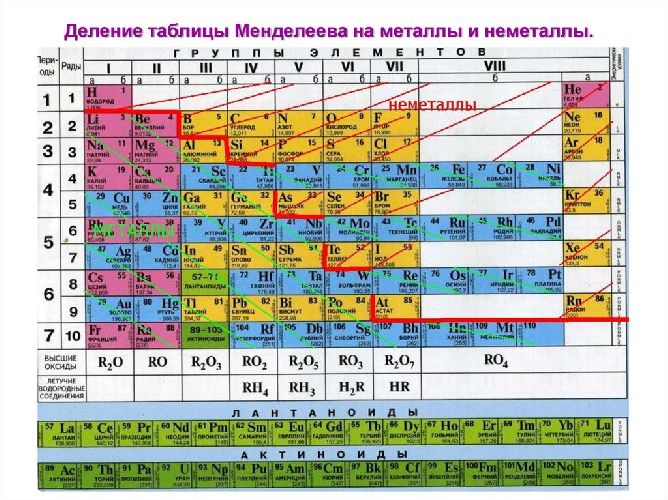
Неметаллические атомы имеют более высокие значения электроотрицательности и, соответственно, высокие энергии ионизации и высокое сродство к электрону. В связи с этим природа неметаллов такова, что они, в отличие от металлов, могут проявлять окислительные свойства. В реакциях они могут восстанавливаться путем добавления такого количества электронов, что их общее число на внешнем уровне достигает восьми (завершенный уровень, устойчивое состояние атома). Именно поэтому отрицательное значение степени окисления, которое неметаллы могут иметь в соединениях, в отличие от металлов, равно разнице (группа 8-N). Самая высокая электроотрицательность обнаружена у неметаллов, положение которых находится в правом верхнем углу таблицы Менделеева, то есть у галогенов фтора и хлора, а также кислорода. Именно эти элементы могут образовывать ионные связи. Наиболее активным неметаллом является фтор, который в соединениях может проявлять только I валентность и степень окисления -1.
Особенности строения неметаллов заключаются в том, что внешний электронный слой у большинства атомов неметаллов содержит от 4 до 8 электронов.
Другие неметаллы (кроме фтора) также могут проявлять положительные степени окисления и образовывать ковалентные связи с другими элементами.
Физические свойства
Большинство неметаллов простых веществ в твердом агрегатном состоянии характеризуются молекулярной кристаллической решеткой. То есть эти неметаллы представляют собой кристаллические вещества. Поэтому в обычных условиях они принимают форму газов, жидкостей или твердых тел с низкими температурами плавления. Примерами таких веществ являются газы: водород Н2, неон Ne, жидкость — бром Br2, твердые вещества йод I2, сера S8, фосфор Р4 (белый фосфор). Существуют неметаллы (бор, углерод, кремний), имеющие атомные кристаллические решетки.

Важнейшие элементы, которые содержаться в живых организмах – органогены. Они образуют воду, белки, витамины, жиры. К ним относятся 6 элементов: углерод, кислород, водород, азот, фосфор, сера.
Химические свойства и соединения
Водородные соединения неметаллов — это преимущественно летучие соединения, кислые в водных растворах. Они имеют молекулярные структуры, ковалентные полярные связи. Некоторые из них (вода, аммиак, фтороводород) образуют водородные связи. Соединения образуются в результате прямого взаимодействия неметаллов и водорода. Электронная формула серы с водородом выглядит следующим образом:
Все водородные соединения – восстановители (кроме HF), причем их восстановительная сила возрастает справа налево по периоду и сверху вниз по подгруппе.
Неметаллы взаимодействуют с металлами и другими неметаллами:
В результате получается натриевая соль соляной кислоты

соединения неметаллов с кислородом, как правило, являются кислотными оксидами, которым соответствуют кислородосодержащие кислоты. Структура оксидов типичных неметаллов молекулярная (SO3, P4 O10). Чем выше степень окисления неметалла, тем сильнее соответствующая оксокислота. Так, хлор непосредственно не взаимодействует с кислородом, однако образует ряд оксокислот, которым соответствуют оксиды, ангидриды этих кислот.
Неметаллы используются в различных отраслях промышленности. Вот список отраслей, где их использование наиболее востребовано.
| Область использования | Примеры, перечень неметаллов, используемых в конкретной отрасли |
| промышленность | Серу, азот и фосфор часто используют для получения кислот. Сера также используется в производстве резины. |
| транспорт | важным неметаллом в транспортной отрасли является водород. Его используют в качестве топлива. При сгорании этот вид топлива не загрязняет окружающую среду. |
| сельскохозяйственный сектор | серу используют для борьбы с вредными насекомыми и болезнями растений |
| лекарство | Кислород используется для восстановления дыхания (кислородные подушки), уголь в виде активированного угля, способного выводить вредные вещества из организма. |
| пищевая промышленность | азот используется для продления срока годности продуктов |
Что мы узнали?
В этой статье по химии для 9-го класса кратко суммируются основные сведения о неметаллах, их структуре и о том, с чем неметаллы реагируют. Неметаллы могут представлять собой газы, жидкости и твердые тела с кристаллической решеткой. Самый активный неметалл — фтор, имеющий степень окисления -1.








Комментирование закрыто