
При изучении химических веществ важными понятиями являются такие величины, как молярная масса, плотность вещества и молярный объем. Итак, что такое мольный объём и чем он отличается для веществ в разных агрегатных состояниях?
Молярный объем: общая информация
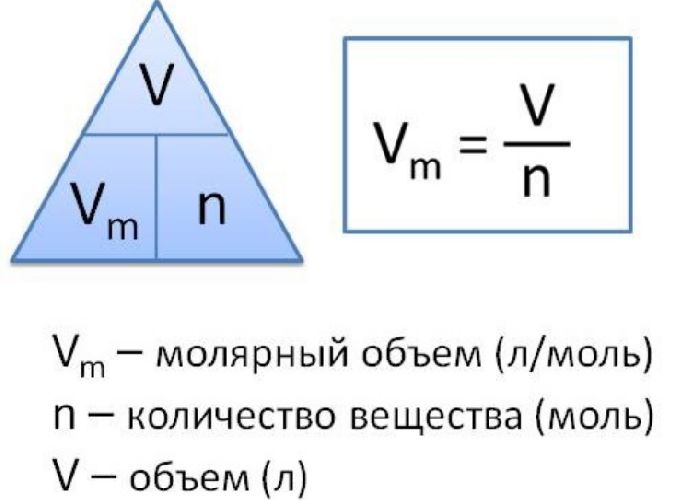
Чтобы рассчитать молярный объем химического вещества, необходимо молярную массу этого вещества разделить на его плотность. Таким образом, мольный объем рассчитывается по формуле:
где Vm – мольный объем вещества, M – молярная масса, p – плотность. В международной системе СИ эта величина измеряется в кубических метрах на моль (м 3 /моль).
Молярный объем газообразных веществ отличается от веществ в жидком и твердом состояниях тем, что газообразный элемент в количестве 1 моль всегда занимает один и тот же объем (при соблюдении одних и тех же параметров).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа.
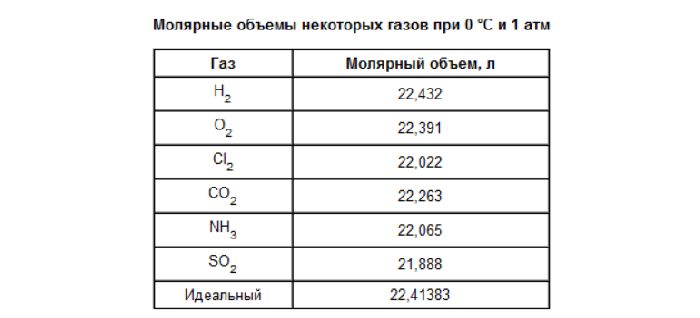
Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм 3 /моль. Этот объем называется молярным объемом идеального газа. То есть в 1 моль любого газа (кислорода, водорода, воздуха) объём равен 22,41 дм 3 /м.
Молярный объем при нормальных условиях можно получить, используя уравнение состояния идеального газа, называемое уравнением Клайперона-Менделеева:
где R – универсальная газовая постоянная, R=8,314 Дж/моль*К=0,0821 л*атм/моль К
Объем одного моля газа V=RT/P=8,314*273,15/101,325=22,413 л/моль, где Т и Р — значения температуры (К) и давления при нормальных условиях.
Закон Авогадро
В 1811 А. Авогадро выдвинул гипотезу о том, что равные объёмы различных газов при одинаковых условиях (температуре и давлении) содержат одинаковое число молекул. Позднее гипотеза подтвердилась и стала законом, носящим имя великого итальянского учёного.
Закон становится понятным, если вспомнить, что в газообразном виде расстояние между частицами несравнимо больше размеров самих частиц.
Таким образом, из закона Авогадро можно сделать следующие выводы:
- В равных объемах всех газов, взятых при одинаковой температуре и одинаковом давлении, содержится одинаковое число молекул.
- 1 моль совершенно разных газов в одинаковых условиях занимает один и тот же объем.
- Один моль любого газа при нормальных условиях занимает объем 22,41 литра.
Следствие закона Авогадро и понятия молярного объема основано на том, что в одном моле любого вещества содержится одинаковое количество частиц (для газов — молекул), равное постоянной Авогадро.
Чтобы узнать число молей растворенного вещества содержится в одном литре раствора, необходимо определить молярную концентрацию вещества по формуле c=n/V, где n – количество растворенного вещества, выражаемое в молях, V – объем раствора, выражаемый в литрах С – молярность.
Что мы узнали?
В программе химической школы в 8 классе изучается тема «Молярный объем». В одном моле газа всегда содержится один и тот же объем, равный 22,41 куб.м/моль. Этот объем называется молярным объемом газа.








Комментирование закрыто