
Чтобы узнать состав любых газообразных веществ, необходимо уметь оперировать такими понятиями, как молярный объем, молярная масса и плотность вещества. В этой статье мы рассмотрим, что такое молярный объем и как его рассчитать?
Количество вещества
Количественные расчеты производятся для того, чтобы реально осуществить определенный процесс или найти состав и строение определенного вещества. Эти расчеты нецелесообразно производить с абсолютными значениями массы атомов или молекул в связи с тем, что они очень малы. Также в большинстве случаев нельзя использовать относительные атомные массы, поскольку они не относятся к общепринятым мерам массы или объема вещества. Поэтому было введено понятие количества вещества, которое обозначается греческой буквой v (ню) или п. Количество вещества пропорционально числу структурных единиц (молекул, атомных частиц), находящихся в этом веществе. Единицей измерения вещества является моль.
моль – это такое количество вещества, которое содержит столько же структурных единиц, сколько атомов содержится в 12 г изотопа углерода.
Масса 1 атома равна 12 эм, следовательно количество атомов в 12 г изотопа углерода равно:
Физическая величина Na называется постоянной Авогадро. В одном моле любого вещества содержится 6,02*10 в силу 23 частиц.

Молярный объем газа
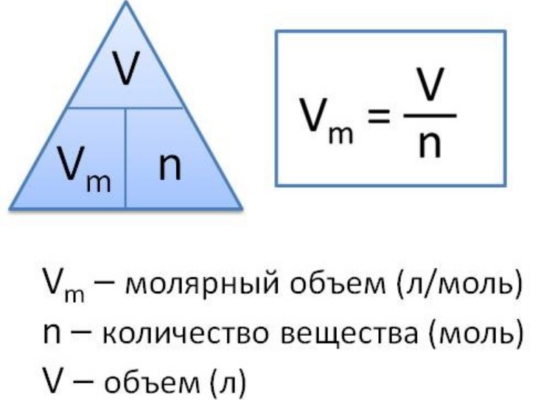
Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эта величина рассчитывается путем деления молярной массы вещества на его плотность по следующей формуле:
где Vm – мольный объем, M – молярная масса, p – плотность вещества.
В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м3 /моль)
Молярный объем газообразных веществ отличается от веществ в жидком и твердом состояниях тем, что газообразный элемент в количестве 1 моль всегда занимает один и тот же объем (при соблюдении одних и тех же параметров). Объем газа зависит от температуры и давления, поэтому при расчете следует брать объем газа при нормальных условиях. Нормальными условиями считаются температура 0 градусов и давление 101325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм3/моль. Этот объем называется молярным объемом идеального газа. То есть в 1 моле любого газа (кислорода, водорода, воздуха) объем равен 22,41 дм3/м.

Таблица «молярный объем газов»
В следующей таблице показаны объемы некоторых газов:
| Газ | Молярный объем, л |
| Н2 | 22 432 |
| О2 | 22 391 |
| Кл2 | 22 022 |
| СО2 | 22 263 |
| NH3 | 22 065 |
| SO2 | 21 888 |
| Идеально | 22.41383 |
Что мы узнали?
Молярный объем газа, изучаемого по химии (8 класс), наряду с молярной массой и плотностью, являются необходимыми величинами для определения состава того или иного химического вещества. Особенностью молярного газа является то, что в одном моле газа всегда содержится один и тот же объем. Этот объем называется молярным объемом газа.








Комментирование закрыто