
К металлам относится большая часть элементов таблицы Менделеева – 82 химических элемента. Какими свойствами они обладают и чем отличаются от неметаллов?
Общая характеристика
Металлы – группа элементов, находящихся в виде простых веществ, обладающих металлическими свойствами (пластичностью, ковкостью, блеском, электронной проводимостью и др.)
Основное отличие металлических элементов в том, что они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления, как у элементарных положительно заряженных ионов, так и у сложных ионов, где они образуют положительные центры.
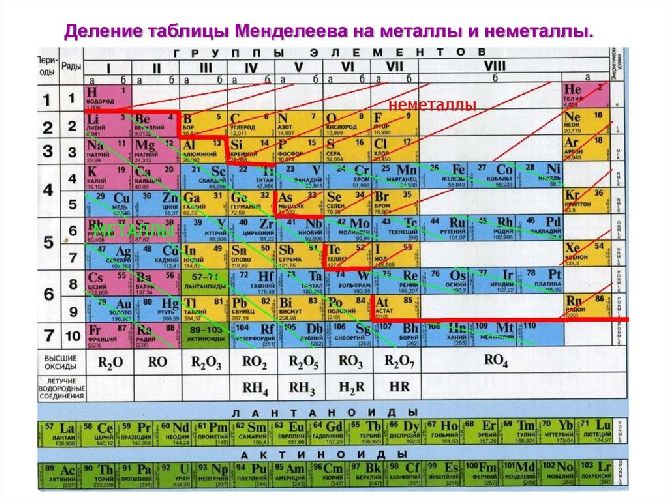
Как правило, на внешнем уровне металлических элементов имеется небольшое количество электронов (1-3), значения электроотрицательности низкие. К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы ниже бор-астатовой линии. Типичные металлы имеют большие размеры атомов, что позволяет им легко терять валентные электроны. Образующиеся положительные ионы стабильны, поскольку имеют полную внешнюю электронную оболочку.
Физические и химические свойства
Все металлы, кроме ртути, находятся в обычных условиях в виде простых веществ, находящихся в твердом агрегатном состоянии и образующих металлическую кристаллическую решетку.

Таблица «Металлы»
В следующей таблице показаны группы основных металлов:
| Группа металлов | Металл |
| Щелочной | литий, натрий, калий и др. |
| Щелочная почва | кальций, стронций, барий и др. |
| Переходный | уран, титан, железо, платина и т д. |
| после перехода | алюминий, свинец, олово и т д. |
| Огнеупорный | молибден, вольфрам |
| Цветной | медь, титан, магний и т д. |
| Благородный | золото, серебро и т д. |
Металлы ковки и податливы, особенно если на внешнем электронном уровне атомов имеется только один электрон: слои атомов движутся относительно друг друга, не разрушая кристаллическую решетку (щелочные металлы, медь, серебро, золото). Атомы непластичных хрупких металлов хрома и марганца имеют большое количество валентных электронов.
Плотность, твердость и температура плавления металлов изменяются в широких пределах и зависят от атомной массы, атомной структуры и геометрии кристаллической решетки. Самый легкий металл — литий (плотность 0,53 г/см3), самый тяжелый — осмий (плотность 22,5 г/см3). Металлы плотностью выше 5 г/см3 относят к тяжелым, а менее 5 г/см3 – к легким.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы реагируют как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют практически со всеми неметаллическими окислителями (кислород, сера, азот и др.):
Металлы также реагируют со сложными веществами, такими как оксиды и гидроксиды, разбавленными растворами кислот и щелочей, растворенными в воде.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают

Нахождение металлов и способы их получения
Самый распространенный металлический элемент на Земле – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в естественном состоянии (золото, ртуть, платина), но в основном они встречаются в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Что мы узнали?
Металлы – вещества, обладающие высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В этой статье по химии для 9 класса рассматриваются их физические и химические свойства, формулы классов металлов, а также способы получения.








Комментирование закрыто