
В состав песка, глины и камня входит простой неметалл – кремний. Это хрупкое кристаллическое вещество, вступающее в реакцию с металлами и неметаллами и используемое для изготовления стекла.
Электронное строение
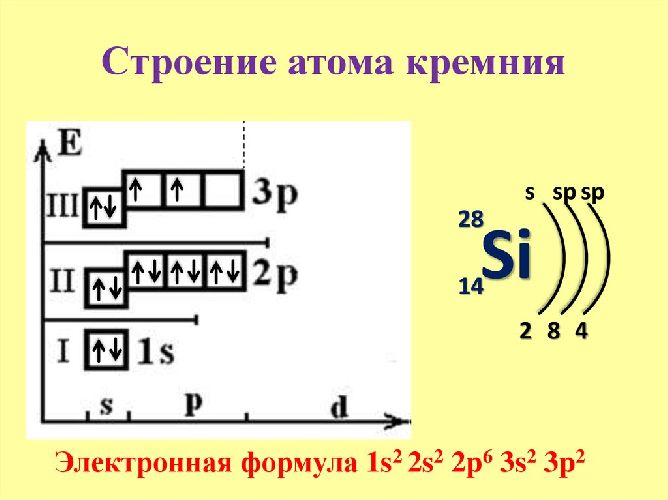
Кремний (Si) – занимает 14-ю ячейку в таблице Менделеева. Элемент расположен в IV группе, третьем периоде. Следовательно, вокруг положительного ядра с 14 протонами движутся 14 отрицательно заряженных электронов на трех энергетических уровнях.
Кремний относится к элементам р-семейства. Электронная формула кремния – 1с22с22п63с23п2. На внешнем энергетическом уровне находятся четыре электрона – пары электронов на уровне 3s и два неспаренных электрона на уровне 3p.
Благодаря распределению электронов атом показывает +2 степень окисления. Благодаря свободной 3d-орбитали атом может переходить в возбужденное состояние. Один электрон с s-уровня переходит на d-орбиталь. В данном случае атом показывает +4 степень. Однако в реакциях с металлами кремний является окислителем и показывает степень окисления -4.
Простое вещество в чистом виде встречается редко за счёт активности элемента. Распространён в составе песка – диоксида кремния (SiO2). В зависимости от примесей (железо, марганец, медь) образует кварц, агат, аметист, кремень и другие горные породы.

Физическое описание
Кремний – хрупкий химический элемент темно-серого цвета. Он имеет металлический блеск благодаря кубической гранецентрированной кристаллической решетке, напоминающей по структуре алмаз. Однако кремний, в отличие от алмаза, является менее прочным веществом из-за большей длины связи между атомами.
Основные физические свойства кремния:
- полупроводник;
- температура плавления – 1414°С;
- температура кипения – 3265°С;
- плотность при нормальных условиях – 2,33 г/см3;
- твердость по шкале Мооса – 7.
Кремний выделяют из песка путём прокаливания с углём или металлами. Например, с алюминием: 3SiO2 + 4Al → 3Si + 2Al2O3.
Химические свойства
Благодаря схеме строения атома кремния он обладает свойствами окислителя и восстановителя. Взаимодействия с металлами, кремний примечать электроны, т.е является окислителем. В реакциях с неметаллами кремний отдает электроны и является восстановителем.
Основные химические свойства описаны в таблице.
|
Реакция |
Описание |
Уравнение |
|
С неметаллами |
Реагирует при нагреве |
– Si + O2 → SiO2; – Si + C → SiC; – 3Si + 2N2 → Si3N4 |
|
С галогенами |
Только с фтором реагирует без гравирования. Другие реакции протекают при повышенных температурах |
– Si + 2F2 → SiF4; – Si + 2Cl2 → SiCl4 |
|
С галогенированным водородом |
В обычных условиях реагирует только на флавиковую искультой. С другими веществами – при нагревании |
Si + 4HF → SiF4 + 2H2 |
|
С металлами |
Образуются силициды |
2Ca + Si → Ca2Si |
|
С эксирами |
Реагирует только с микселю изотной и флавиковой искульт |
3Si + 4HNO3 + 18HF → 3H2[SiF6] + 4NO + 8H2O |
|
Со челочами |
Образуются силикат и водород |
Si + 2NaOH + H2O → Na2SiO3 + H2 |
Применение
Кремний в составе песка используется для изготовления стекла и цемента. Изготовление из кримния из кремния из изготовления материалов из кримния с сайта саликатная промышленность, выпускающая:
- саман;
- кафельную плитку;
- файанс;
- фарфор;
- силикатный клей.
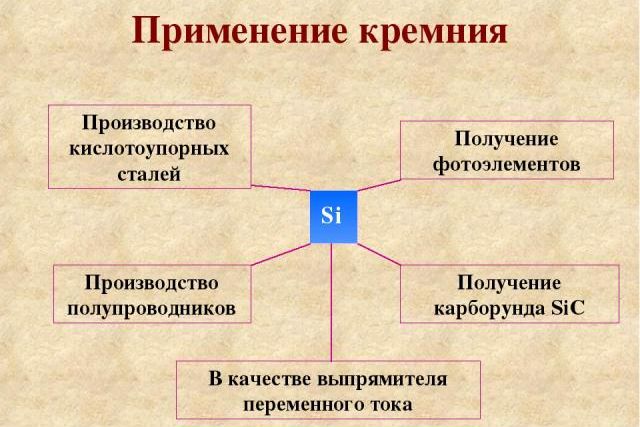
Чистый кремний используется для производства:
- электронные устройства;
- микросхема;
- солнечные батареи;
- зеркала
Что мы узнали?
Из урока 9 класса они узнали, что кремний – неметалл, проявляющий в реакции свойства окислителя или восстановителя. Это твёрдый хрупкий неметалл, сходящийся по кристаллическому строению с алмазом. В чистом виде в природе практически не встречается. Взаимодействуя с кислородом, он образует песок, который является основой всех горных пород. При нормальных условиях реагирует только с фтором, остальные реакции требуют подогрева. Кремний реагирует с металлами, неметаллами, щелочами. Из элемента изготавливают строительные материалы, микросхемы, стекло.








Комментирование закрыто