
Ковалентная связь – это связь, которая чаще всего связывает атомы неметаллов в молекулах и кристаллах. О том, какую химическую связь называют ковалентной, мы поговорим в этой статье.
Что такое ковалентная химическая связь?
Ковалентная химическая связь — это связь, возникающая за счет образования общих (связывающих) электронных пар.
Если между двумя атомами имеется одна общая пара электронов, такая связь называется простой; если их два, то это двойное; если три, то тройное.
Связь обычно обозначается горизонтальной линией между атомами. Например, в молекуле водорода имеется одинарная связь: HH; в молекуле кислорода имеется двойная связь: О=О; В молекуле азота имеется тройная связь:
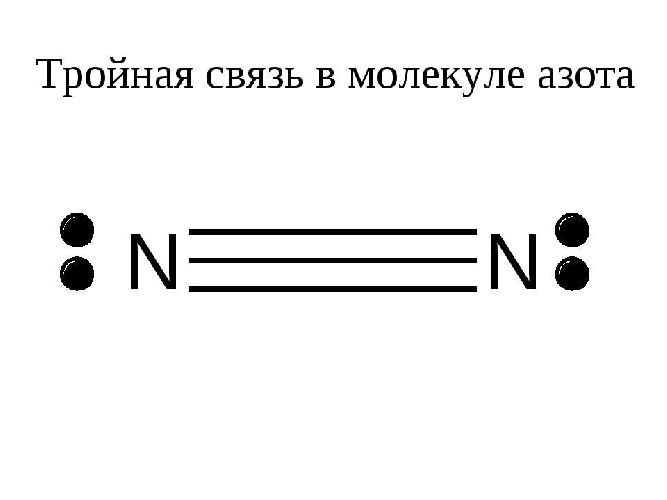
Чем выше кратность связи, тем прочнее молекула: наличие тройной связи объясняет высокую химическую устойчивость молекул азота.
Образование и виды ковалентной связи
Существует два механизма образования ковалентной связи: обменный механизм и донорно-акцепторный механизм:
- обменный механизм. В механизме обмена для образования общей электронной пары каждый из двух связывающих атомов отдает по одному неспаренному электрону. Именно это происходит, например, при образовании молекулы водорода.
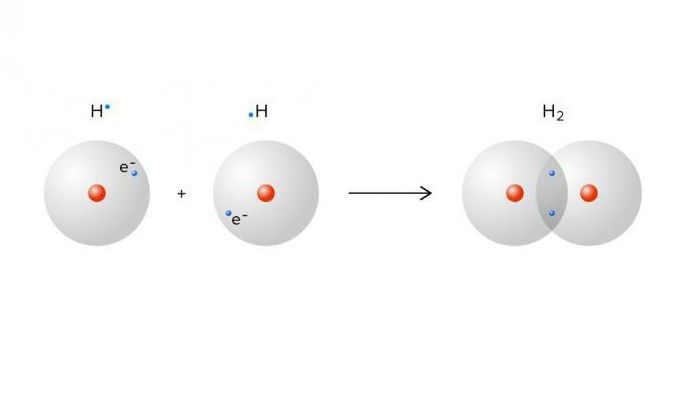
Каждому из связанных атомов принадлежит общая электронная пара, то есть их электронная оболочка является целостной.
- донорно-акцепторный механизм. В донорно-акцепторном механизме общая электронная пара представлена одним из связывающих атомов, тем, который более электроотрицательен. Другой атом представляет собой пустую орбиталь для общей электронной пары.
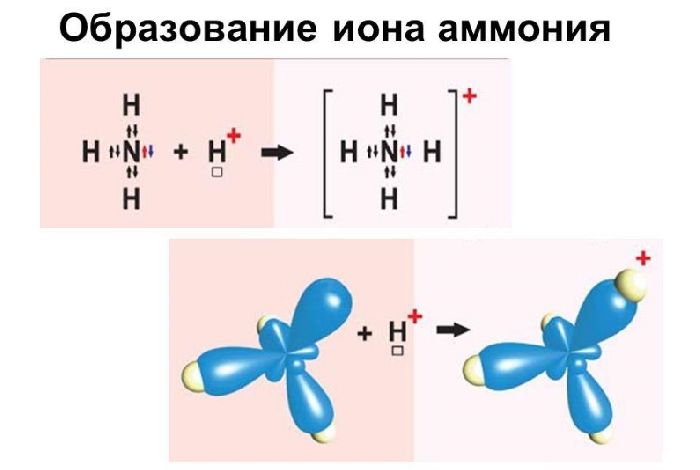
Так образуется ион аммония NH4+. Этот положительно заряженный ион (катион) образуется при реакции газообразного аммиака с любой кислотой. В кислом растворе присутствуют катионы водорода (протоны), которые в водородной среде образуют катион гидроксония H3O+. Формула аммиака — NH3: молекула состоит из одного атома азота и трех атомов водорода, соединенных одинарными ковалентными связями по обменному механизму. Атом азота остается с одной неподеленной парой электронов. Он отдает его как регулярный, как донор, иону водорода Н+, имеющему свободную орбиталь.
Ковалентные химические связи в химических веществах могут быть полярными и неполярными. Связь не имеет дипольного момента, то есть полярности, если связаны два атома одного и того же элемента, имеющие одинаковое значение электроотрицательности. Итак, в молекуле водорода связь неполярна.
В молекуле хлористого водорода HCl атомы разной электроотрицательности соединены одной ковалентной связью. Общая электронная пара смещена в сторону хлора, который имеет более высокое сродство к электрону и электроотрицательность. Возникает дипольный момент и связь становится полярной. При этом происходит частичное разделение зарядов: атом водорода становится положительным концом диполя, а атом хлора — отрицательным концом.
Любая ковалентная связь обладает следующими характеристиками: энергия, длина, кратность, полярность, поляризуемость, насыщаемость, направленность в пространстве
Что мы узнали?
Ковалентная химическая связь образуется в результате перекрытия пары облаков валентных электронов. Этот тип связи может образовываться по донорно-акцепторному механизму, а также по обменному механизму. Ковалентная связь может быть полярной или неполярной и характеризуется наличием длины, кратности, полярности и направления в пространстве.








Комментирование закрыто