
Количественная характеристика, показывающая направление реакции и изменение концентрации веществ, называется константой равновесия химической реакции. Константа равновесия зависит от температуры и природы реагентов.
Обратимые и необратимые реакции
Все реакции можно разделить на два типа:
- обратимый, течет одновременно в двух взаимно противоположных направлениях;
- необратимый, течет в одном направлении с полным расходованием хотя бы одного исходного вещества.
Необратимые реакции обычно приводят к образованию нерастворимых веществ в виде осадка или газа. К таким реакциям относятся:
- горение:
C2H5OH + 3O2 → 2CO2 + H2O;
- разложение:
2KMnO4 → K2MnO4 + MnO2 + H2O;
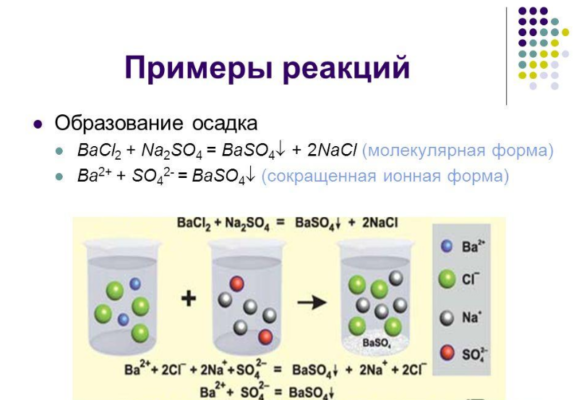
- связь с образованием осадка или газа:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl.
Обратимые реакции возможны только при определенных постоянных условиях. Исходные вещества дают начало новому веществу, которое тут же распадается на составляющие и снова собирается воедино. Например, в результате реакции 2NO + O2 ↔ 2NO2 оксид азота (IV) легко расщепляется на оксид азота (II) и кислород.
Равновесие
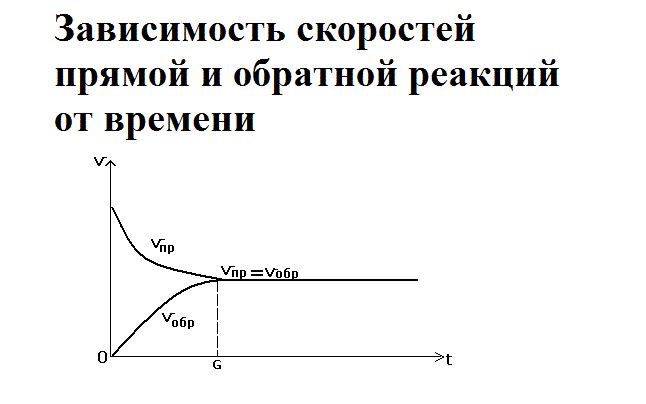
Через определенное время скорость обратимой реакции снижается. Достигается химическое равновесие — состояние, при котором не происходит изменения концентрации исходных веществ и продуктов реакции с течением времени, поскольку скорости прямой и обратной реакций выравниваются. Равновесие возможно только в гомогенных системах, т е все реагирующие вещества являются либо жидкостями, либо газами.
Рассмотрим химическое равновесие на примере реакции водорода с йодом:
- прямая реакция –
Н2 + И2 ↔ 2HI;
- неудача –
2HI ↔ H2 + I2.
Как только смешиваются два реагента – водород и йод, йодоводорода еще не существует, так как реагируют только простые вещества. Большое количество исходных веществ активно реагируют друг с другом, поэтому скорость прямой реакции будет максимальной. В этом случае обратной реакции не происходит и скорость равна нулю.
Скорость прямой реакции можно выразить графически:
где кпр – константа скорости прямой реакции.
Со временем реагенты расходуются и концентрация снижается. Следовательно, скорость прямой реакции снижается. При этом увеличивается концентрация нового вещества – йодистого водорода. Накопившись, он начинает разлагаться, и скорость обратной реакции увеличивается. Это может быть выражено как
Йодоводород в квадрате, так как коэффициент молекулы равен двум.
В определенный момент скорости прямой и обратной реакций становятся равными. Наступает состояние химического равновесия.
Равновесие можно сместить либо в сторону исходных веществ, либо в сторону продуктов реакции. Смещение под воздействием внешних факторов называется принципом Ле Шателье. На равновесие влияют температура, давление, концентрация одного из веществ.
Расчёт константы
В равновесном состоянии протекают обе реакции, но при этом концентрации веществ находятся в равновесии (образуются равновесные концентрации), так как скорости сбалансированы (νпр = νрев).
Химическое равновесие характеризуется константой химического равновесия, которая выражается сводной формулой:
Константы скорости реакции можно выразить через соотношение скоростей реакций. Возьмем условное уравнение обратной реакции:
Тогда скорости прямой и обратной реакций будут равны:
- νпр = кпр ∙ [А]па ∙ [Б]пб
- νrev = требуется ∙ [C]pc ∙ [D]pd.
Следовательно, если
что
Отсюда мы можем выразить связь между константами:
Это соотношение равно константе равновесия:
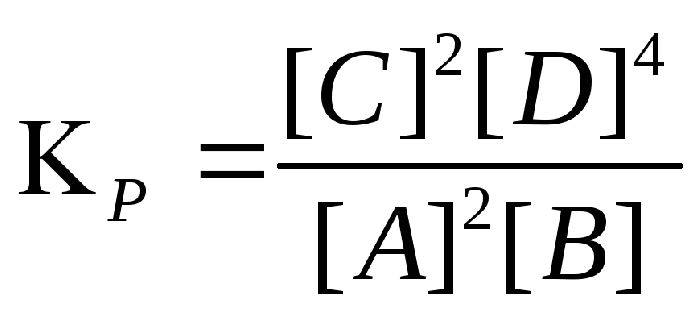
Величина показывает, во сколько раз скорость прямой реакции больше скорости обратной реакции.
Что мы узнали?
В зависимости от конечных продуктов реакции подразделяют на обратимые и необратимые. Обратимые реакции идут в обоих направлениях: исходные вещества образуют конечные продукты, которые распадаются на исходные вещества. В ходе реакции скорости прямой и обратной реакций уравновешиваются. Это состояние называется химическим равновесием. Его можно выразить как отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ.








Комментирование закрыто