
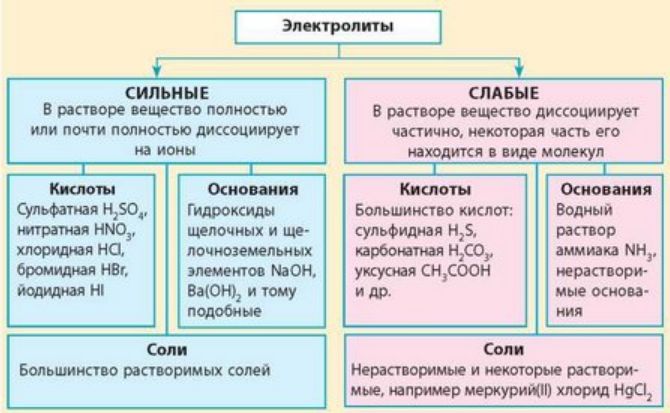
Вещества, растворы которых проводят электрический ток, называются электролитами. В зависимости от степени диссоциации различают слабые и сильные электролиты. Степень диссоциации – это величина, указывающая на состояние равновесия в реакции.
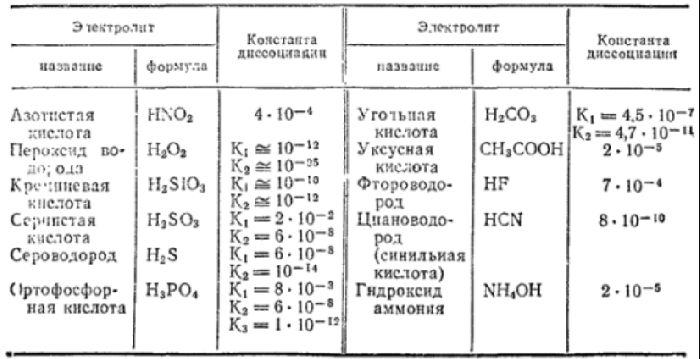
Константа диссоциации
К сильным электролитам относятся сильные кислоты, щелочи и соли. Они полностью растворяются и быстро распадаются на ионы. В этом случае реакция диссоциации необратима.
Слабые электролиты практически не распадаются на ионы при электролитической диссоциации. К ним относятся слабые кислоты, плохо растворимые соли и основания. Диссоциация слабых электролитов обратима.
Степень диссоциации показывает отношение распавшихся молекул к общему числу молекул электролита. Степень диссоциации слабых электролитов зависит от константы равновесия диссоциации. Чем выше значение константы диссоциации, тем больше электролит распадается на ионы, т.е тем выше степень диссоциации.
Схематически электролитическую диссоциацию слабых электролитов можно выразить уравнением:
где:
- КА – первоначальное подключение;
- К+ – катион;
- А– – анион.
Константа равновесия такой реакции равна:
где:
- [К+] – концентрация катионов;
- [А–] – концентрация анионов;
- [КА] — концентрация исходного соединения.
Степень диссоциации уменьшается при увеличении концентрации электролита. Чем больше вещества смешивается с водой, тем медленнее происходит диссоциация.
Гидролиз
Реакция между веществом и водой, в которой образуется новое соединение, называется гидролизом. В результате взаимодействия веществ с молекулами воды образуется слабый электролит.
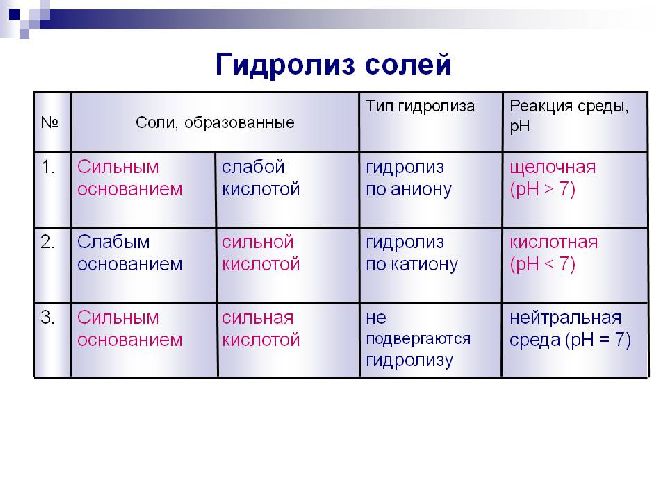
Гидролизу подвергаются органические вещества (реакция необратимая), а неорганические соли (реакция обратимая). Как происходит гидролиз солей, описано в таблице.
|
Вид |
Гидролиз |
Примеры |
|
Соль, образованная слабым основанием и сильной кислотой |
По катиону |
FeCl2 + H2O ↔ Fe(OH)Cl + HCl: Fe2++ 2Cl– + H+ + OH– ↔ FeOH+ + 2Cl– + H+ |
|
Соль, образованная сильным основанием и слабой кислотой |
Аниона |
Na2CO3 + H2O ↔ NaHCO3 + NaOH: 2Na+ + CO32- + H2O ↔ 2Na+ + HCO3– + OH– |
|
Соль, образованная слабым основанием и слабой кислотой |
Из катиона и аниона |
ZnS + 2HOH → Zn(OH)2↓ + H2S↑: Zn2+ + S2- + 2HOH → Zn(OH)2↓ + H2S↑ |
Гидролиз соли, образованной сильным основанием и сильной кислотой, не идёт.
Гидролиз характеризуется двумя взаимосвязанными понятиями:
- степень — соотношение между количеством соли, подвергшейся гидролизу (Сгидр), и общей концентрацией соли (Тот);
- константа – равновесие гидролитической реакции.
Степень гидролиза можно выразить формулой:
Константа гидролизной диссоциации указывает на способность соли гидролизоваться.
Степень гидролиза зависит от силы кислот или оснований, образующих соль. Чем слабее кислота или основание, тем выше степень гидролиза соли.
Что мы узнали?
Взаимодействие кислот и оснований с водой называется реакцией диссоциации. Она характеризуется степенью и константой диссоциации. Степень – это доля распавшихся молекул к общему числу молекул вещества. Константа отражает степень равновесия реакции диссоциации. Взаимодействие соли и воды с образованием новых соединений называется гидролизом. Эта реакция также характеризуется степенью и константой.








Комментирование закрыто