
Кислоты – это активные соединения, способные взаимодействовать с различными веществами. Классификация кислот зависит от кислотного остатка.
Что такое кислоты?
Кислота образуется из атомов водорода и кислотного остатка, который обычно состоит из неметаллов или их оксидов. Общая формула кислот — HnAc, где H — водород, n — число атомов водорода, Ac — кислотный остаток. Например, плавиковая кислота (HF) имеет один атом водорода, а кислотная часть состоит из фтора. Угольная кислота (H2CO3) имеет два атома водорода, а оставшаяся кислота представляет собой окись углерода.

Свойства кислых растворов определяются активными ионами водорода (Н+). Водород может замещать металлы, в результате чего образуются кислые соли (кислотный остаток остается неизменным).
Основные свойства кислот:
- прозрачные жидкости, редко — твердые вещества (HPO3, H3BO3);
- растворим в воде (исключение – H2SiO3);
- иметь кислый вкус;
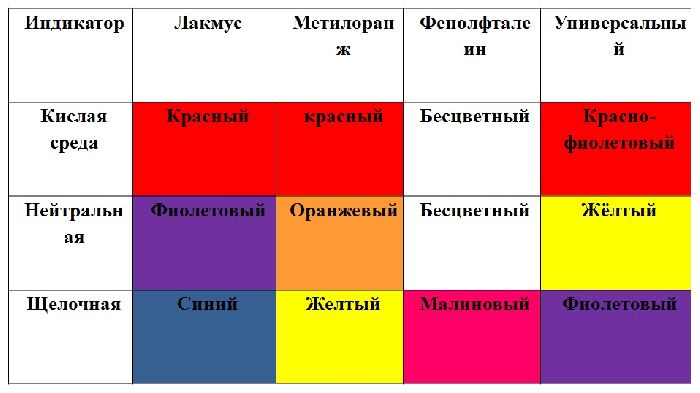
- изменить цвет индикаторов на красный (фенолфталеин становится бесцветным);
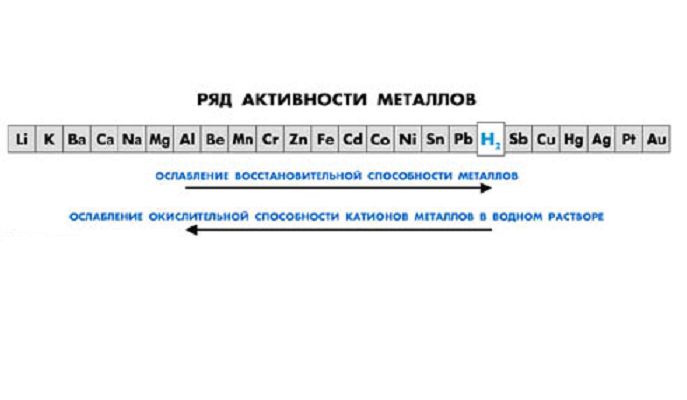
- взаимодействует с металлами в ряду активности до водорода.
Кислоты образуются следующими способами:
- при взаимодействии неметаллов с водородом (H2 + Cl2 → 2HCl);
- в результате реакции оксидов с водой (SO3 + H2O → H2SO4);
- при взаимодействии оксидов с водой (P2O5 + 3H2O → 2H3PO4);
- в результате реакции твердых солей с кислотами (2NaCl + H2SO4 → Na2SO4 + 2HCl).
Кислоты относятся к электролитам. Это значит, что при растворении в воде они распадаются на катионы и анионы. Кислоты с сильной степенью диссоциации считаются сильными кислотами (H2SO4, HCl). Электролиты со слабой диссоциацией относятся к слабым кислотам (H2S, H2SO3).
Виды
Кислоты можно разделить на две большие группы:
- в присутствии или отсутствии кислорода;
- с количеством атомов водорода.
Подробная классификация и свойства кислот приведены в таблице.
|
Вид |
Характеристики |
Примеры |
|
Бескислородный |
Не содержит кислорода. В составе присутствует только водород и кислотный остаток, образованный неметаллами |
HCl, HBr, HI, HF, H2S, HCN |
|
Насыщенный кислородом |
Кислый остаток содержит кислород |
HNO3, H2SO4, HMnO4, HNO2, H2SO3, H3PO4, H2CO3, H2SiO3 |
|
Монобаза |
Кислота содержит только один атом водорода |
HNO3, HCl, HMnO4 |
|
Двухосновной |
Соединение содержит два атома водорода |
H2SO4, H2CO3, H2SiO3 |
|
Трехосновной |
Содержит три атома водорода |
H3PO4 |
Одни и те же кислоты можно классифицироваться по-разному. Например, азотная кислота (HNO3) относится как к кислородсодержащему, так и к одноосновному виду.
Что мы узнали?
Еще в 8 классе мы узнали, что такое кислоты, какими свойствами они обладают и как их получают. Кислоты состоят из водорода, который при взаимодействии с солями, оксидами, свободными элементами и кислотным остатком может замещаться металлом. Кислоты классифицируются по двум свойствам — наличию кислорода и числу атомов водорода. Кислород входит в состав кислотного остатка и соединяется с неметаллом (за исключением HMnO4). Число атомов водорода может варьироваться от одного до трех. Одни и те же кислоты могут быть разных типов.








Комментирование закрыто