Химическая реакция – это процесс, в котором одно или несколько исходных веществ превращаются в другие вещества. Итак, какие химические реакции существуют?
Типы химических реакций
Химические реакции классифицируются по ряду признаков:
1. Путем изменения степени окисления. Если в ходе химической реакции один или несколько элементов меняют степень окисления, такую реакцию классифицируют как окислительно-восстановительную реакцию. Например, реакция железа с фтором является окислительно-восстановительной, так как и железо, и хлор меняют степень окисления:

Железо в этой реакции приобретает положительный заряд, что может произойти только тогда, когда оно отдает электроны (заряд ядра не меняется, а значит, электронов становится меньше). Хлор получает отрицательный заряд, что может произойти только тогда, когда он присоединяет электроны (заряд ядра не меняется, то есть электронов становится больше). Таким образом, суть окислительно-восстановительной реакции – это процесс переноса электронов от одного атома к другому, выражающийся в изменении степени окисления.
2. По количеству и составу исходных и получаемых веществ:
а) сложная реакция – из двух простых или сложных веществ образуется одно сложное вещество. Примером может служить та же реакция железа с хлором.
б) реакция разложения – из одного сложного вещества образуются два и более простых или сложных веществ. Эти реакции могут быть или не быть окислительно-восстановительными. Им всегда нужна энергия для работы. Например, производство негашеной извести CaO путем нагревания известняка CaCO3 не является окислительно-восстановительной реакцией:
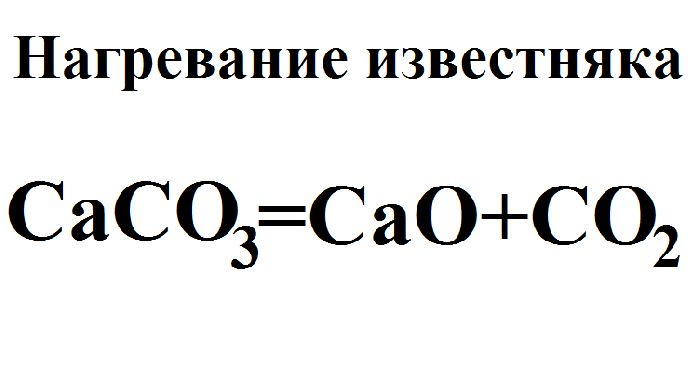
в) реакция замещения – взаимодействие сложного и простого вещества, в результате которого образуются новое сложное и новое простое вещество. Все реакции замещения являются окислительно-восстановительными. Например, взаимодействие цинка с серной кислотой, приводящее к образованию водорода и соли цинка:
г) реакция обмена – взаимодействие двух сложных веществ, в результате которого образуются два новых сложных вещества. Например, взаимодействие двух солей хлорида натрия NaCl и нитрата серебра AgNO3 :
Реакции обмена не являются окислительно-восстановительными
3. В соответствии с тепловым эффектом при любой реакции одни химические связи разрываются, а другие образуются. Соотношение этих энергетических процессов определяет тепловой эффект реакции.
Реакции, которые идут с выделением тепла, называют экзотермическими, а реакции, которые идут с поглощением тепла, называют эндотермическими.
4. На основе обратимости. Есть реакции, идущие до завершения, то есть до тех пор, пока исходные вещества полностью не превратятся в продукты реакции.
Например:
Такие реакции называются необратимыми. Другие реакции протекают в этих условиях во взаимно противоположных направлениях, т е продукты реакции одновременно превращаются в исходные вещества. Это обратимые реакции.
Например:
Кроме того, если прямая реакция является экзотермической, то обратная реакция является эндотермической, с одинаковым количественным значением выделяемой или поглощаемой энергии.

Что мы узнали?
Предмет «Химические реакции» изучается в 11 классе школы. Все химические реакции можно классифицировать по обратимости, тепловому эффекту, количеству и составу исходных и образующих веществ, а также изменению степени окисления.








Комментирование закрыто