
Ионная химическая связь – это связь, которая образуется между атомами химических элементов (положительно или отрицательно заряженными ионами). Так что же такое ионная связь и как она образуется?
Общая характеристика ионной химической связи
Ионы — это частицы, имеющие заряд, который атомы приобретают в процессе отдачи или принятия электронов. Они достаточно сильно притягиваются друг к другу, в связи с чем вещества с таким типом связи имеют высокие температуры кипения и плавления.
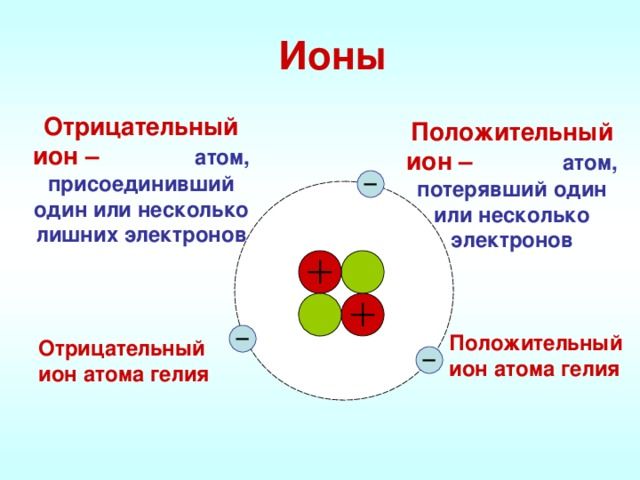
Ионная связь – это химическая связь между разнородными ионами, возникающая вследствие их электростатического притяжения. Ее можно считать предельным случаем ковалентной связи, когда разница в электроотрицательности связанных атомов настолько велика, что происходит полное разделение зарядов.
Обычно считается, что связь приобретает электронный характер, если ЭО >1,7.
Разница в значении электроотрицательности тем больше, чем дальше друг от друга находятся элементы в таблице Менделеева за период. Эта связь характерна для металлов и неметаллов, особенно принадлежащих к крайним группам, таким как I и VII.
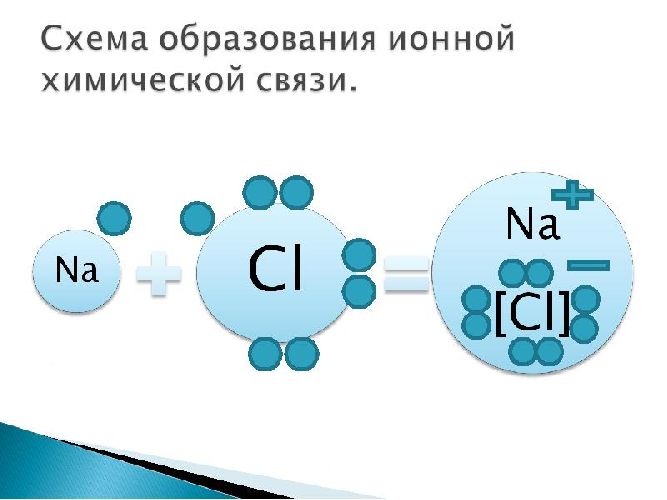
Пример: поваренная соль, хлорид натрия NaCl:
В кристаллах существует ионная связь; он сильный и длинный, но не насыщенный и не распрямленный. Ионная связь характерна только для сложных веществ, таких как соли, щелочи и оксиды некоторых металлов. В газообразном виде такие вещества существуют в виде ионных молекул.
Ионные химические связи образуются между типичными металлами и неметаллами. Электроны обязательно переходят от металла к неметаллу, образуя ионы. В результате возникает электростатическое притяжение, называемое ионной связью.
На самом деле полностью ионной связи не встречается. Так называемая ионная связь носит частично ионный, частично ковалентный характер. Однако связь сложных молекулярных ионов может считаться ионной.
Примеры образования ионной связи
Есть несколько примеров образования ионной связи:
- взаимодействие кальция и фторида
— кальцию легче отдать два электрона, чем приобрести недостающие.
— Наоборот, фтору легче принять один электрон, чем отдать семь электронов.
Найдем наименьшее общее кратное между зарядами образующихся ионов. Оно равно 2. Определим количество атомов фтора, которые примут два электрона от атома кальция: 2 : 1 = 2,4.
Составим формулу ионной химической связи:
- взаимодействие натрия и кислорода
– натрий находится в основной подгруппе первой группы. Он легко может отдать один электрон.
– кислород находится в основной подгруппе шестой группы. Естественно, ему легче получить два электрона, чем отказаться от шести.
Найдем наименьшее общее кратное между зарядами образующихся ионов. Оно равно 2:1=2. Определим количество атомов натрия, которые отдадут два электрона атому кислорода: 2. 4.
Нарисуем схему образования ионной связи:
Что мы узнали?
Ионная связь и ионы изучаются в 11 классе. Ионная химическая связь — это связь между положительными и отрицательными ионами, осуществляемая между металлами и неметаллами.








Комментирование закрыто