
Химическое равновесие – это состояние в системе, при котором обе реакции – прямая и обратная – имеют одинаковые скорости. Чем характеризуется это явление и какие факторы влияют на химическое равновесие?
Химическое равновесие. Общая характеристика
Химическое равновесие можно понимать как состояние в химической системе, при котором начальное количество веществ, участвующих в реакции, не меняется с течением времени.
Химическое равновесие можно разделить на три типа:
- истинное равновесие — это равновесие, характеризующееся постоянством во времени при отсутствии внешних воздействий. При изменении внешних условий меняется и состояние системы, но после восстановления условий состояние также остается прежним. Состояние истинного равновесия можно рассматривать с двух сторон: со стороны продуктов реакции и со стороны исходных веществ.
- метастабильное (кажущееся) равновесие – это состояние возникает, когда не выполняются некоторые условия истинного равновесия.
- заторможенное (ложное) равновесие – это состояние системы, которое необратимо изменяется при изменении внешних условий.
Смещение равновесия в химических реакциях
Химическое равновесие зависит от трех параметров: температуры, давления и концентрации вещества. Французский химик Анри Луи Ле Шателье в 1884 году сформулировал принцип динамического равновесия, согласно которому равновесная система под воздействием внешних воздействий стремится вернуться в состояние равновесия. То есть под внешним воздействием равновесие сместится таким образом, что это влияние нейтрализуется.

Принципы сформулированные Ле Шателье еще называют принципами «смещения равновесия в химических реакциях».
На химическое равновесие влияют следующие факторы:
- температура. При повышении температуры химическое равновесие смещается в сторону поглощения реакции. При понижении температуры равновесие смещается в сторону инициирования реакции.

Реакция поглощения называется эндотермической реакцией, а реакция выделения – экзотермической.
- давление. Если давление при химической реакции увеличивается, то химическое равновесие смещается в сторону наименьшего объема вещества. Если давление уменьшается, то равновесие смещается в сторону наибольшего объема вещества. Этот принцип применим только к газам и не применим к твердым телам.
- концентрация. Если в ходе химической реакции увеличить концентрацию одного из веществ, равновесие сместится в сторону продуктов реакции, а если концентрацию уменьшить, равновесие сместится в сторону исходных веществ.
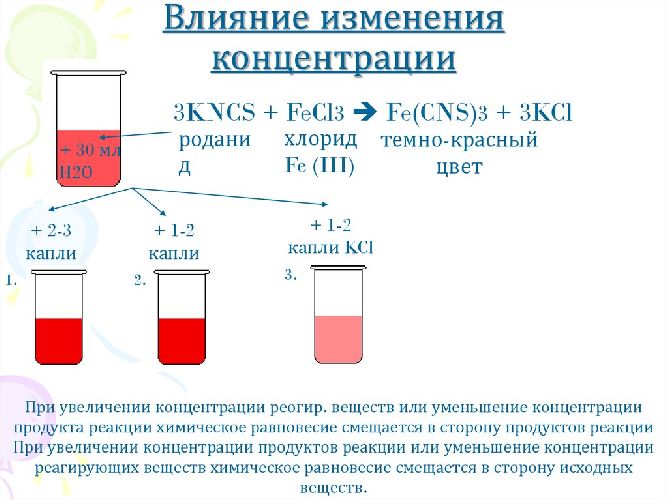
Катализатор не относится к факторам, влияющих на смещение химического равновесия.
Что мы узнали?
В химическом равновесии скорости каждой пары реакций равны. Химическое равновесие, изучаемое в 9 классе, можно разделить на три типа: истинное, метастабильное (кажущееся), заторможенное (ложное). Термодинамическая теория химического равновесия была впервые сформулирована учёным Ле Шателье. На равновесие системы влияют всего три фактора: давление, температура и концентрация исходного вещества.








Комментирование закрыто