
Водород – газ, он стоит на первом месте в таблице Менделеева. Название этого широко распространенного в природе элемента переводится с латыни как «порождающий воду». Итак, какие физические и химические свойства водорода мы знаем?
Водород: общая информация
В обычных условиях водород не имеет ни вкуса, ни запаха, ни цвета.

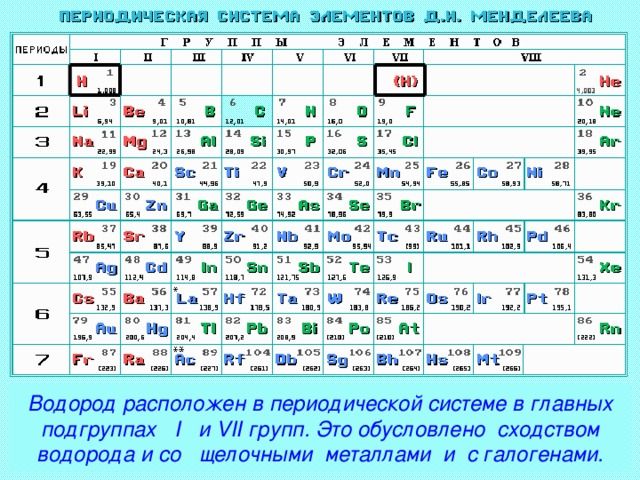
Поскольку атом имеет один электронный энергетический уровень, который может удерживать максимум два электрона, в стабильном состоянии атом может либо принять один электрон (степень окисления -1), либо отдать один электрон (степень окисления +1), демонстрируя постоянную валентность I. Именно по этой причине символ элемента водорода помещается не только в группу IA (основную подгруппу группы I) вместе с щелочными металлами, но и в группу VIIA (основная подгруппа группы VII) вместе с галогены. Атомам галогенов также не хватает одного электрона для заполнения внешнего уровня, и они, как и водород, являются неметаллами. Водород проявляет положительную степень окисления в соединениях, где он связан с более электроотрицательными неметаллическими элементами, и отрицательную степень окисления в соединениях с металлами.
У водорода есть три изотопа, каждый из которых имеет собственное название: протий, дейтерий, тритий. Количество последнего на Земле ничтожно.
Химические свойства водорода
В простом веществе Н2 связь между атомами прочная (энергия связи 436 кДж/моль), поэтому активность молекулярного водорода невысока. В обычных условиях он реагирует только с высокореактивными металлами, а единственным неметаллом, с которым реагирует водород, является фтор:
Водород реагирует с другими простыми (металлы и неметаллы) и сложными (оксиды, неуточненные органические соединения) веществами либо при облучении и повышении температуры, либо в присутствии катализатора.
Водород сгорает в кислороде и выделяет значительное количество тепла:
Смесь водорода с кислородом (2 объема водорода и 1 объем кислорода) при поджигании сильно взрывается и поэтому носит название гремучего газа. При работе с водородом следует соблюдать правила техники безопасности.

В присутствии катализаторов газ может реагировать с азотом:
— в результате этой реакции при высоких температурах и давлении в промышленности образуется аммиак.
При высоких температурах водород способен реагировать с серой, селеном и теллуром, а при их взаимодействии со щелочными и щелочноземельными металлами происходит образование гидридов:
— в данном случае водород играет роль окислителя.
Водород обладает способностью восстанавливать оксиды многих металлов при повышении температуры, что приводит к образованию воды. Например:
— в этом процессе водород является восстановителем
Что мы узнали?
Водород — самый распространенный элемент в космосе. В учебной статье рассматриваются химические свойства водорода и взаимодействие этого газа с металлами. В обычных условиях он способен реагировать с очень небольшими количествами металлов и неметаллов, а в измененных условиях реагирует с азотом, серой, селеном, щелочными металлами, а также способен восстанавливать оксиды.








Комментирование закрыто