
Алкадиены, диены или диеновые углеводороды представляют собой класс линейных ненасыщенных углеводородов, которые содержат в молекуле две двойные связи. Химические и физические свойства алкадиенов определяются наличием кратных связей и существенно отличаются от свойств предельных углеводородов.
Гомологи
Для образования двух двойных связей в молекуле необходимо минимум три атома углерода. Следовательно, пропадиен является простейшим представителем класса алкадиенов. Это бесцветный газ, образующий гомологический ряд диенов с общей формулой CnH2n-2. Названия гомологов образуются с помощью суффикса «-диен».
Представители гомологического ряда:
- С3Н4 – пропадиен;
- С4Н6 – бутадиен;
- С5Н8 – пентадиен;
- С6Н10 – гексадиен;
- С7Н12 – гептадиен;
- С8Н14 – октадиен;
- С9Н16 – нонадиен;
- С10Н18 – десятилетие.
Алкадиены получают из нефтепродуктов, галогеналканов, спиртов с помощью дегидрирования.
Виды
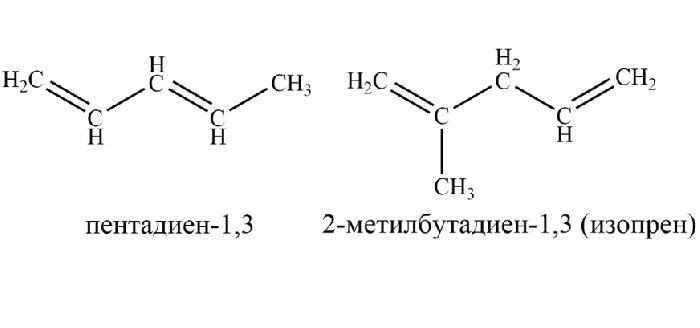
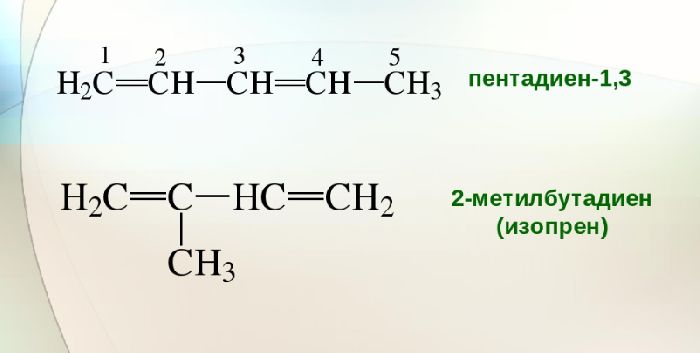
Диенам, начиная с пентадиена, свойственна изомерия:
- структурные – основаны на углеродном скелете и расположении двойных связей.
- пространственная – цис-транс-изомерия.
Алкадиены классифицируются на основе структурной изомерии в зависимости от расположения кратных связей. В зависимости от положения двойной связи в молекуле по отношению друг к другу различают три типа диенов:
- кумулятивный – три соседних атома углерода соединены двойными связями (характерны для бутадиена и выше): СН2=С=СН-СН3 – бутадиен-1,2;
- сопряженные – атомы углерода с двойными связями разделены одинарной связью: СН2=СН-СН=СН2 – бутадиен-1,3;
- изолированные – атомы углерода с двойными связями разделены несколькими одинарными связями (характерно для пентадиена и выше): СН2=СН-СН2-СН=СН2 – пентадиен-1,4.
Отсчёт атомов углерода в молекуле изомера начинается с разветвлённого края или с того края, к которому ближе всего расположены двойные связи. При зеркальном расположении разветвлений и двойных связей выбирается любой край для начала отсчёта. Положение заместителей указывается в начале названия, двойных связей – в конце.
Свойства
По общим физическим свойствам алкадиены аналогичны алкенам:
- пропадиен и бутадиен — легко сжижаемые газы;
- гомологи изомеров С5-С17 представляют собой жидкости;
- высшие диены с 18 и более атомами углерода являются твердыми веществами.

Плотность, температура плавления и кипения увеличиваются с увеличением молекулярной массы. Структурные изомеры имеют более низкие температуры плавления и кипения по сравнению с линейными молекулами.
Благодаря двойным связям диены могут вступать в реакции присоединения. Радикалы присоединяются к местам, где связи разорваны. В зависимости от положения двойных связей в одних и тех же реакциях образуются разные вещества.
В таблице описаны химические свойства алкадиенов.
|
Реакция |
Описание |
Уравнение |
|
Гидрирование |
Реакция в присутствии никеля |
СН2=СН-СН=СН2 + 2H2 → СН3-СН2-СН2-СН3 |
|
Галогенирование |
При добавлении брома или хлора образуются тетрагалогеналканы. В зависимости от положения двойных связей образуются 1,2- и 1,4-соединения. Их соотношение зависит от условий реакции |
CH2=CH-CH=CH2 + Br2 → CH2(Br)-CH(Br)-CH=CH2 + CH2(Br)-CH=CH-CH2-Br |
|
Гидрогалогенирование |
Похоже на галогенирование. Реакция протекает в спиртовой или водной среде в присутствии хлорида лития |
СН2=СН-СН=СН2 + HBr → СН3-СН(Br)-СН=СН2 + СН3-СН=СН-СН2-Br |
|
Полимеризация |
Образование десен |
nCH2=CH-CH=CH2 -> (-CH2-CH=CH-CH2-)n |
Что мы узнали?
Диены или алкадиены – это ненасыщенные углеводороды с двумя двойными связями. Гомологический ряд образует пропадиены. Гомологам, начиная с пентадиена, свойственна структурная и пространственная изомерия. Структурная изомерия возникает в положении заместителя или в положении двойной связи. В зависимости от числа атомов углерода алкадиены могут находиться в газах (С3-С4), жидкостях (С5-С17) или твердых веществах (начиная с С18). Диены участвуют в дополнительных реакциях: гидрировании, галогенировании, гидрогалогенировании, полимеризации.








Комментирование закрыто