
Азот был экспериментально открыт шотландским химиком Д. Резерфордом в 1772 г. В природе азот находится преимущественно в свободном состоянии и является одним из основных компонентов воздуха. Каковы физические и химические свойства азота?
Общая характеристика
Азот — химический элемент V группы периодической системы Менделеева, атомный номер 7, атомная масса 14, формула азота — N2. Перевод названия элемента – «безжизненный» – может относиться к азоту как к единому веществу. Однако азот в связанном состоянии — один из основных элементов жизни; входит в состав белков, нуклеиновых кислот, витаминов и т д.
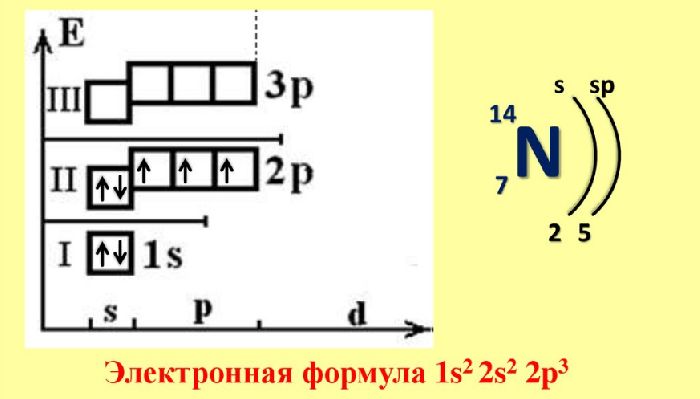
Азот – элемент второго периода, не имеет возбужденных состояний, так как атом не имеет свободных орбиталей. Но этот химический элемент может проявлять в основном состоянии не только III, но и IV валентность за счет образования ковалентной связи по донорно-акцепторному механизму с участием неподеленной электронной пары азота. Степень окисления азота варьируется в широких пределах от -3 до +5.
при изучении строения молекулы азота необходимо помнить, что химическая связь осуществляется за счет трех общих пар p-электронов, орбитали которых направлены по осям x, y, z.
Химические свойства азота
В природе азот встречается в виде одного вещества — газа N2 (объемная доля в воздухе 78%) и в связанном состоянии. В молекуле азота атомы соединены прочной тройной связью. Энергия этой связи составляет 940 кДж/моль. При обычных температурах азот может реагировать только с литием (Li3N). После предварительной активации молекул нагреванием, облучением или действием катализаторов азот реагирует с металлами и неметаллами. Азот может реагировать с магнием, кальцием или, например, алюминием:
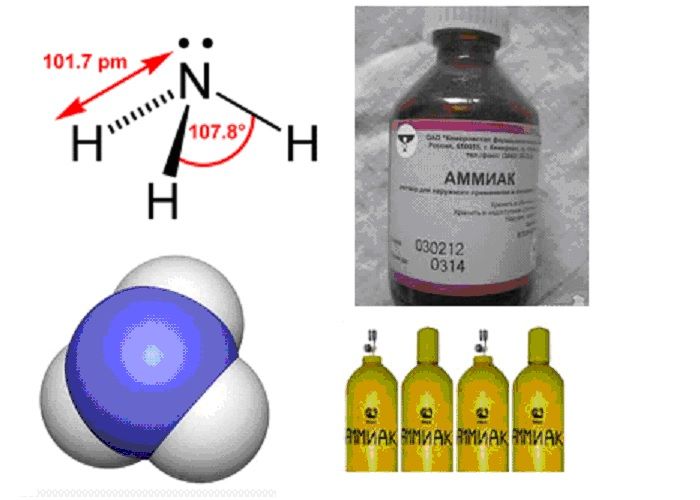
Особенно важен синтез аммиака из простых веществ – азота и водорода в присутствии катализатора (губчатое железо):N2+3H2=2NH3+Q. Аммиак – бесцветный газ с резким запахом. Он хорошо растворим в воде, что в значительной степени обусловлено образованием водородных связей между молекулами аммиака и воды, а также реакцией присоединения к воде по донорно-акцепторному механизму. Слабощелочная реакция раствора обусловлена наличием в растворе ионов OH- (в небольшой концентрации, так как степень диссоциации гидроксида аммония очень мала – это слабое растворимое основание).
Из шести оксидов азота — N2O, NO, N2O3, NO2, N2O4, N2O5, где азот имеет степень окисления от +1 до +5, первые два — N2O и NO — несолеобразующие, остальные реагируют с образовывать соли.
Азотную кислоту, важнейшее соединение азота, получают в промышленности из аммиака в 3 стадии:
- окисление аммиака на платиновом катализаторе:
- окисление NO до NO2 кислородом воздуха:
- поглощение NO2 водой избытком кислорода:
Азот также может реагировать при высоких температурах и давлениях (в присутствии катализатора) с водородом:

Применение азота
Азот в основном используется как исходный продукт для синтеза аммиака, а также для производства азотной кислоты, минеральных удобрений, красителей, взрывчатых веществ и других азотсодержащих соединений. Жидкий азот используется в холодильных системах. Для придания стали большей твердости, повышения износостойкости, коррозионной стойкости и жаростойкости поверхность насыщают азотом при высоких температурах. Эта сталь выдерживает нагрев до 500 градусов, не теряя своей твердости.
Что мы узнали?
Азот — бесцветный газ без запаха, цвета и вкуса. В школьном курсе химии изучаются его основные свойства, а также способность реагировать с металлами и неметаллами в обычных условиях, а также под действием катализаторов.








Комментирование закрыто