
Аммиак – газообразное вещество с резким неприятным запахом. Какими свойствами он обладает и с какими веществами вступает в реакцию?
Строение молекулы
Электронная формула аммиака выглядит следующим образом:

Из четырех электронных пар атома азота три являются общими, а одна одинокой. В образовании молекулы NH3 участвуют три неспаренных p-электрона атома азота, электронные орбитали которых взаимно перпендикулярны, и 1s-электроны трех атомов водорода. Молекула имеет форму правильной пирамиды: в углах треугольника находятся атомы водорода, а на вершине пирамиды — атом азота. Угол между связями HNH составляет 107,78 градусов.
Физические свойства
Аммиак – бесцветный газ с характерным резким запахом. Температура кипения аммиака -33,4 градуса Цельсия, температура плавления -77,8 градуса.
Аммиак хорошо растворим в воде (при 20 градусах в 1 объеме воды растворяется до 700 объемов аммиака). Концентрированный раствор имеет плотность аммиака 0,91 г/см3.
Раствор аммиака в воде называется аммиачной водой или нашатырным спиртом. При кипячении растворенный аммиак улетучивается из раствора.

Несколько хуже растворяется аммиак в органических растворителях (спирте, ацетоне, хлороформе, бензоле). Аммиак хорошо растворяет многие азотистые вещества.
Жидкий аммиак имеет высокую теплоту парообразования (при -50 градусах 145 кДж/кг, при 0 градусах 1260 кДж/кг, при 50 градусах 1056 кДж/кг).
Молярная масса и молекулярная масса аммиака равна 17
Химические свойства
В химическом отношении аммиак представляет собой достаточно активные реакции с участием аммиака, сопровождающиеся либо изменением степени окисления азота, либо образованием ковалентной связи особого типа. Высокая растворимость химического вещества в воде обусловлена образованием водородных связей между их молекулами.
Аммиак может реагировать со следующими веществами:
- при взаимодействии с кислотами аммиак нейтрализует их, образуя тем самым соли аммония:
- при реакции с галогенами аммиак обычно окисляется до свободного азота:
- при смешивании с кислородом аммиак горит зеленовато-желтым пламенем:
- при нагревании аммиак восстанавливает оксид меди(II) и сам окисляется до свободного азота:
— с помощью этой реакции можно получить кислород в лаборатории.
Получение и применение
В лаборатории аммиак получают нагреванием хлорида аммония NH4Cl с гашеной известью Ca(OH)2 :
– выделившийся аммиак содержит водяные пары.
В промышленности аммиак получают из азота и водорода. Реакция синтеза аммиака протекает с выделением тепла и уменьшением объема:
Необходимая для синтеза аммиака температура достигается за счет предварительного нагрева азотно-водородной смеси и выделения теплоты реакции. Катализатором синтеза аммиака является губчатое железо, активированное некоторыми металлами. Сероводород, кислород, оксид и диоксид углерода, пары и другие смеси, содержащиеся в азотно-водородной смеси, значительно снижают активность катализатора. Синтез проводят при температуре 500-550 градусов и давлении от 15 до 100 МПа.
Схема установки синтеза аммиака выглядит следующим образом:
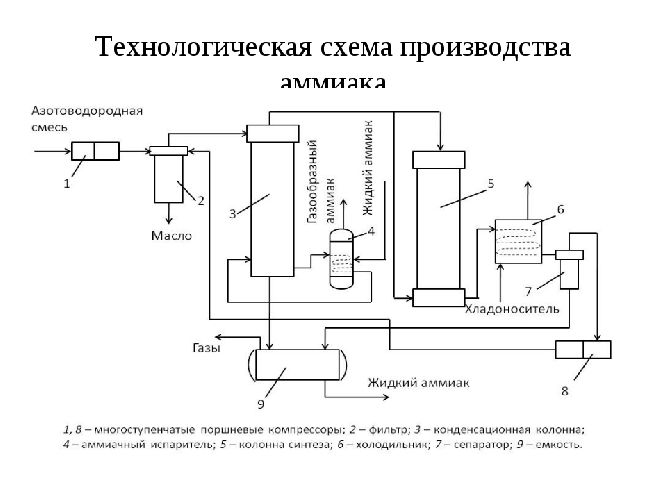
Большая часть синтезируемого в промышленности аммиака используется для производства азотной кислоты и других азотистых веществ. Использование в холодильных установках основано на простом сжижении и последующем испарении с поглощением тепла.
Водные растворы аммиака применяются в химических лабораториях и производствах в качестве слабого легколетучего основания. Также водные растворы используют в медицине и быту.
Что мы узнали?
Изучение аммиака входит в курс химии в начальной школе. Аммиак – химическое соединение, содержащее азот и водород. Газ представляет собой бесцветное вещество с ярко выраженным запахом, реагирует с кислотами, водой, галогенами, кислородом и другими сложными и простыми веществами.








Комментирование закрыто