
Тема урока – атомы и молекулы. Представление о том, что материя состоит из неких элементарных блоков (атомов) зародилось в Древней Греции, в трудах философов-материалистов. Вновь об атомах заговорили в 18-19 веках, когда создавалась молекулярно-кинетическая теория газов.
Учеными 19-го века также было получено число Авагадро $N_A = {6,022 cdot 10^{23}} моль^{-1}$, т.е. количество молекул (атомов) в 1 моле вещества (т.е. в 12 г углерода C-12). Исходя из этого параметра легко получить формулу числа молекул (атомов) в любом количестве вещества: $N = {{m \over M} cdot N_A}$, где M – молярная масса.
Параметры молекул и атомов
Методами химии и физики удалось измерить размеры молекул и атомов, а также их массы.
К примеру, диаметр молекулы кислорода $O_2$ составляет примерно $3 cdot 10^{-10}$ м, а масса $53 cdot 10^-27$ кг. В то же время атом кислорода намного меньше – $d = {4,8 cdot 10^{-11}}$. Его абсолютную массу можно получить, если атомную массу кислорода, взятую из таблицы Менделеева, умножить на $1 a.е.м. = 1,66 cdot 10^{-27} кг$. Тогда масса атома кислорода $m = {15,99 cdot {1,66 cdot 10^{-27}}} = {26,54 cdot 10^{-27}} кг$.
Из сравнения этих величин видно, что масса молекулы кислорода равна сумме масс двух атомов кислорода, но о размерах сказать тоже самое нельзя. Разница в один порядок. Дело в том, что атомы в молекулах находятся на определенном расстоянии друг от друга. В твердых телах это расстояние наименьшее, в газах – наибольшее.
20-й век
Опыты Томсона (1897 г.) и Резефорда (1911 г.) привели к революции: атом более не был элементарной частицей материи. Появилась планетарная модель, согласно которой атом состоял из массивного ядра и вращающегося вокруг него электрона. Позднее Резерфордом и его учениками было установлено, что ядра в свою очередь состоят из протонов (частица с теми же зарядом и массой, что у водорода H-1) и нейтронов (нейтральных частиц, обладающих массой).
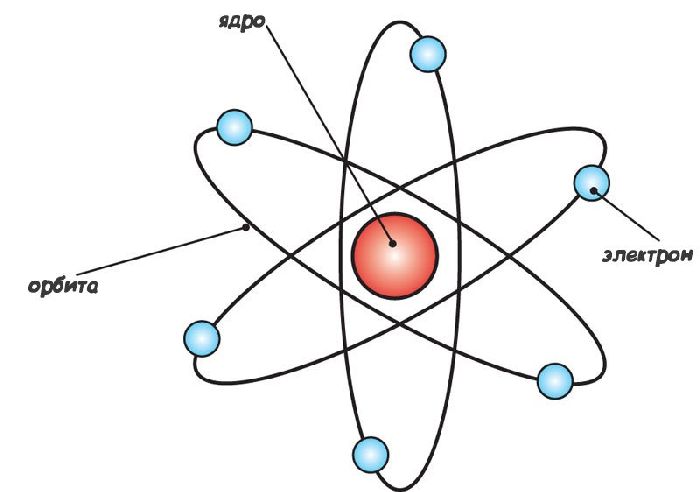
Со временем от планетарной модели отказались. К этому привело противоречие: в классическом представлении вращающиеся электроны должны испускать энергию и в конечном итоге падать на ядро атома. Этого не происходило. Объяснение дала квантово-механическая модель атома.
Задачи
- Какова масса молекулы воды, если молярная масса водорода – 1 моль, а кислорода – 16?
Решение
Так как молекула воды состоит из двух атомов водорода и одного атома кислорода, запишем выражение для молярной массы воды:
$M_{H_2O} = 2M_H + M_O = 18$
Тогда масса воды:
$m = {M_{H_2O} cdot 1 а.е.м.} = {18 cdot {1,66 cdot 10^{-27}}} = {30 cdot {1,66 cdot 10^{-27}}} кг$
- Известно, что масса двухатомной молекулы некоторого вещества равна $97,1 cdot 10^{-27}$. Что это за вещество?
Решение
$M = {m \over N_a} = {97,1 \over 1,66} = 58,5 моль$
Поскольку вещество двухатомное, то 58,5 моль – это сумма молярных масс двух различных атомов. Такую сумму дают молярные массы Na и Cl. Из этого следует, что искомое вещество – хлорид натрия, т.е. соль. Такую же формулу имеет минерал Галит.
Что мы узнали?
В ходе урока были рассмотрены строение атома и молекул, а также проведено сравнение масс некоторых молекул и атомов и их размеров. Для закрепления пройденного материала были решены две простые задачи.








Комментирование закрыто