
Белки являются строительными блоками организма и играют важную роль в обмене веществ. Функции белков разнообразны и имеют большое значение в поддержании процесса жизнедеятельности.
Строение
Белки – это биополимеры, состоящие из отдельных единиц – мономеров, которые называются аминокислотами. Аминокислоты состоят из карбоксильной (-COOH), аминной (-NH2) группы и радикала. Аминокислоты в белке связаны друг с другом посредством ковалентной пептидной связи, образуя полипептидную цепь. Пептидная связь образуется между карбоксильными и аминогруппами соседних аминокислот.
Незаменимые химические элементы аминокислот:
- углерод;
- водород;
- азот;
- кислород.
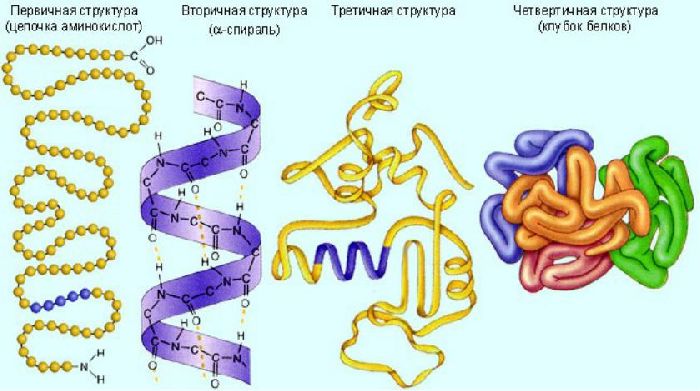
Радикал может включать серу и другие элементы.
По способности синтезироваться в организме различают два типа аминокислот:
- обменные – синтезируются в организме;
- незаменимые – не синтезируются в организме и должны поступать из внешней среды.
Известно около 200 аминокислот. Однако в построении белков участвуют только 20.
Синтез
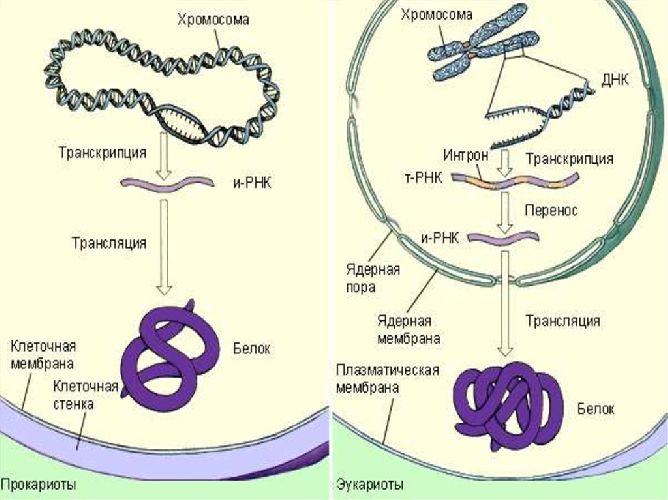
Биосинтез белка происходит в цитоплазме клетки на рибосомах. Это сложный процесс, состоящий из трех этапов:
- транскрипция – образование на участке ДНК информационной (матричной) РНК, содержащей информацию о последовательности аминокислот в белковой молекуле;
- трансляция – синтез полипептидной цепи из аминокислот на основе информационной РНК;
- модификация белка.
Синтез полипептидной цепи происходит на рибосоме с помощью матрицы и транспортной РНК. Информационная РНК содержит информацию о последовательности аминокислот в молекуле белка. Транспортная РНК доставляет аминокислоты к рибосоме и сравнивает их с информацией о информационной РНК. Этот процесс называется трансляцией. Модификация белка предполагает «обучение ошибкам». Части синтезированного белка заменяются, удаляются или расширяются.
Функции
Биологические функции белков представлены в таблице.
|
Функция |
Описание |
Примеры |
|
Транспорт |
Они транспортируют вещества (малые молекулы) через клеточную мембрану, а также участвуют в их транспорте с кровью и другими жидкостями по всему организму. |
Гемоглобин переносит кислород и углекислый газ, транскортин – транспортный белок, встроенный в клеточные мембраны, который участвует в поступлении глюкозы и аминокислот в клетку. |
|
Двигатель |
Обеспечивают сокращение мышечных клеток многоклеточных животных, участвуют в движении жгутиков и ресничек |
Актин, миозин |
|
Структурный (строительный) |
Участвуют в формировании цитоскелета, клеточных органелл и межклеточного вещества. Придаёт силу тканям и клеточным структурам. |
Коллаген и эластин в хрящевой ткани, кератин в волосах и ногтях |
|
Сигнал |
Передача информации между клетками, тканями, органами |
Цитокины |
|
Ферментативный или каталитический |
Большинство ферментов живых организмов имеют белковое происхождение. Они являются катализаторами, ускоряющими биохимические реакции |
Пепсин, каталаза, рибонуклеаза |
|
Регуляторный или гормональный |
Белковые гормоны контролируют и регулируют метаболические процессы |
Инсулин, тиреотропин |
|
Генная регуляция |
Регулируют функции нуклеиновых кислот при передаче генетической информации |
Гистоны регулируют репликацию и транскрипцию ДНК |
|
Энергия |
Используется как дополнительный источник энергии. При растворении 1 г выделяется 17,6 кДж |
Белки используются организмом в качестве источника энергии после углеводов и липидов. |
|
Защитный |
Специфические белки – антитела – защищают организм, уничтожая чужеродные частицы. Специальные белки участвуют в свертывании крови, остановке кровотечений |
Иммуноглобулины, фибриноген, тромбин |
|
Хранилище |
Они хранятся для питания клеток. Сохраняет вещества, необходимые организму |
Ферритин хранит железо, казеин, глютен, альбумин сохраняется в организме |
|
Рецептор |
Различные регуляторы (гормоны, медиаторы) удерживаются на поверхности или внутри клетки |
Рецептор глюкагона, протеинкиназа |
Белки могут оказывать отравляющее и обезвреживающее действие. Например, палочка ботулизма выделяет токсин белкового происхождения, а белок альбумин связывает тяжёлые металлы.
Ферменты
Стоит коротко сказать о каталитической функции белков. Ферменты или энзимы относят к особой группе белков. Они осуществляют катализ – ускорение химической реакции.
По своему строению ферменты могут быть:
- простой – содержит только аминокислотные остатки;
- сложные – помимо белкового остатка в их состав входят небелковые структуры, называемые кофакторами (витамины, катионы, анионы).
Молекулы ферментов имеют активную часть (активный центр), связывающую белок с веществом – субстратом. Каждый фермент «узнает» определенный субстрат и связывается с ним, как «ключ и замок». Активный центр обычно представляет собой «карман», в который попадает субстрат.
Связывание активного центра и субстрата описывается моделью индуцированного соответствия (модель перчатки). Модель показывает, что фермент «адаптируется» к субстрату. Из-за изменения структуры энергия активации реакции уменьшается.
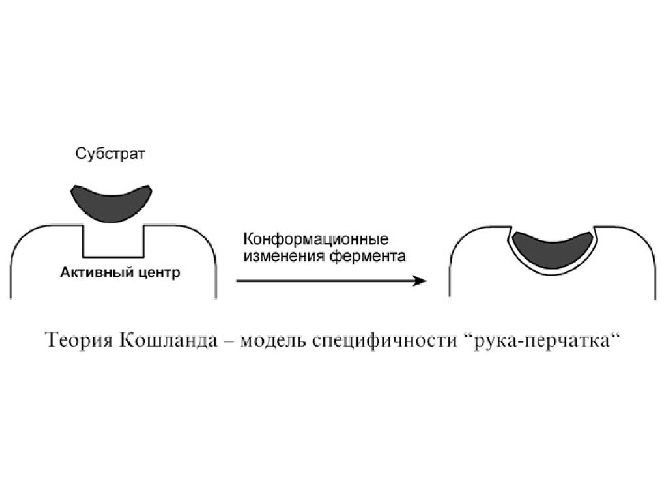
Активность ферментов зависит от нескольких факторов:
- температура;
- концентрации ферментов и субстратов;
- кислотность.
Существует 6 классов ферментов, каждый из которых взаимодействует с определенными веществами. Например, трансферазы переносят фосфатную группу от одного вещества к другому.
Ферменты могут ускорять реакцию в 1000 раз.
Что мы узнали?
Мы выяснили, какие функции выполняют белки в клетке, как они структурированы и как синтезируются. Белки представляют собой полимерные цепи, состоящие из аминокислот. Известно 200 аминокислот, но белки могут образовывать только 20. Белковые полимеры синтезируются на рибосомах. Белки выполняют важные функции в организме: транспортируют вещества, ускоряют биохимические реакции и регулируют процессы, происходящие в организме.






Комментирование закрыто