
Все вещества состоят из атомов, которые формируют структуру (форму, размеры и т.п.) с помощью устойчивых связей. При этом структурная решетка физического тела может состоять либо из отдельных атомов, либо из отдельных однотипных групп атомов — молекул. По виду строения вещества принято разделять на два различных класса: на вещества молекулярного и немолекулярного строения.
Немолекулярные вещества
Вещества, состоящие из одинаковых молекул, каждая из которых имеет в своем составе один и тот же набор атомов, называются молекулярными веществами. К веществам немолекулярного строения относятся вещества, состоящие либо из одиночных атомов, либо из ионных соединений. Приведем некоторые примеры веществ немолекулярного строения:
- Атомные:
- Алмаз (C — углерод);
- Бинарные соединения неметаллов (SiO2 — окись кремния, SiC — карбид кремния );
- Рубин (Al2O3);
- Кремний (Si);
- Металлы: Na, Cu, Fe.
Ионные соединения:
- Соли (NaCl — поваренная соль, сульфат калия — K2SO4,);
- Едкий натр, сода, флюорит;
- Гидриды (LiH);
- Оксиды (CaO, MgO, FeO);
- Основания (NaOH, KOH).
Немолекулярные вещества в обычных условиях находятся в твердом агрегатном состоянии. Их кристаллическая решетка представляет собой правильное, регулярное расположение частиц, из которых они состоят: атомов или ионов в узлах кристаллической решетки. Кристаллические решетки немолекулярных веществ бывают трех типов: атомные, ионные и металлические.
Атомные кристаллические решетки
Атомными называют решетки, в узлах которых расположены единичные атомы. В решетках этого типа атомы связаны между собой крепкими ковалентными связями. Ярким примером вещества с такой решеткой служит алмаз.
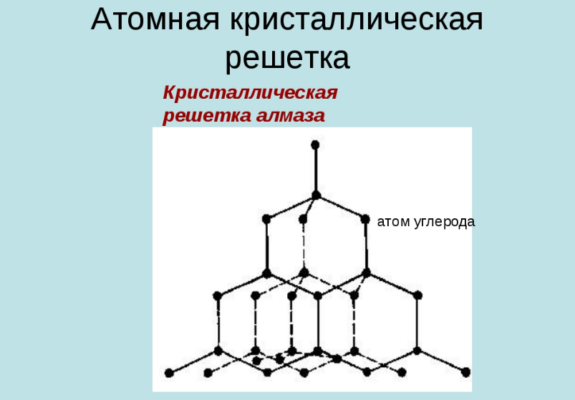
Это минерал (часть горнорудной породы), который является одной из модификаций углерода — С (химическая формула). Элементарная ячейка алмаза представляет собой куб. В вершинах находится по одному атому. Кроме этого, в каждой грани по одному атому и еще четыре — внутри куба. Атомы соединены очень прочными ковалентными связями. Такая структура и “упаковка” считается наиболее плотной. Благодаря этому достигаются высокие характеристики твердости.
Кроме высокой твердости вещества с атомной кристаллической решеткой характеризуются высокими температурами плавления (у алмаза Тплав = 35000С) и низкой растворимостью.
После специальной обработки (огранки) алмазы превращают в самые популярные ювелирные украшения — бриллианты. В промышленности алмазы находят свое применение в качестве абразивов (материалы для обработки поверхности) и прочных покрытий для инструментов. Кстати, несмотря на высокую твердость алмаз довольно хрупок — его можно разрушить резким ударным воздействием.
Металлические кристаллические решетки
В узлах этих решеток расположены атомы и ионы (атомы превращаются в ионы, отдавая электроны со своих внешних орбит). Такое строение определяет основные физические свойства металлов: пластичность, ковкость, высокие показатели тепло- и электропроводности, непрозрачность и присущий металлам блеск.
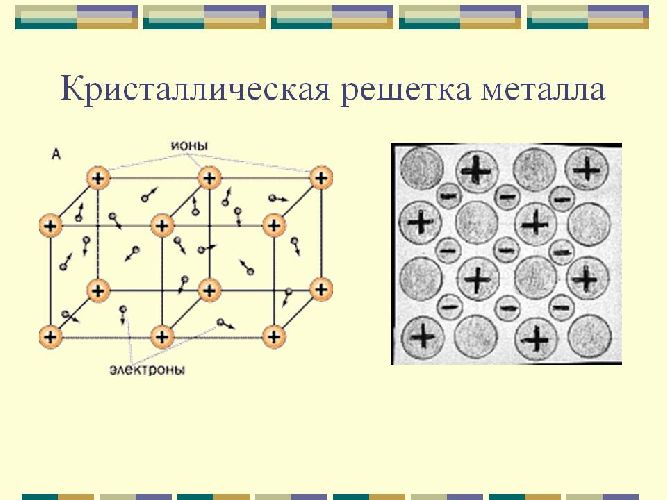
Металлическая и атомная кристаллические решетки очень похожи, но, тем не менее, их физические свойства существенно различаются. Например, в отличие от веществ с атомными (типа алмаза) все металлы обладают высокой электропроводностью и теплопроводностью. Тип связи в этих решетках называется металлическим. К этим веществам относятся все металлы (Fe, Hg, Cu, Na и т.д.) и металлические сплавы.
Ионные кристаллические решетки
В узлах ионных кристаллических решеток расположены отрицательно и положительно заряженные ионы, между которыми образуются отдельный тип связей — ионный. Ионы могут быть как простые (Na+, Cl−), так и сложные (SiO42−, OH−). Ионные кристаллические решетки характерны для оксидов и гидрооксидов металлов. Например, решетка употребляемой нами ежедневно поваренной соли представляет собой куб, с чередующимися в узлах положительными ионами Na+ и отрицательными Cl−.
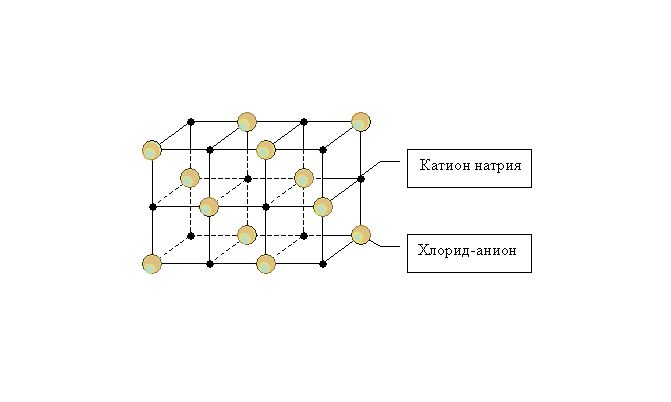
Металлические связи характеризуются высокой устойчивостью. В следствие этого вещества с этим типом решетки имеют высокие показатели твердости и прочности. Ионные соединения имеют высокие температуры кипения и плавления. Однако, многие ионные вещества хорошо растворяются в воде.
Примеры ионных веществ: Хлорид натрия (NaCl), селитра (NH4NO3), сернокислый алюминий (Al2(SO4)3), исландский шпат (CaCO3).
Исландский шпат обладает большим набором полезных оптических свойств. Он используется более чем в двухстах типах оптических приборах: микроскопах, поляриметрах, калориметрах, спектрофотометрах, дальномерах, сахариметрах, лазерах и т.д.
Что мы узнали?
Итак, мы узнали, что к веществам с немолекулярным строением относятся твердые вещества, состоящие либо из одинаковых атомов, либо из ионов различных атомов, расположенных в узлах кристаллической решетки. Немолекулярные вещества в обычно находятся в твердом агрегатном состоянии. Кристаллические решетки немолекулярных веществ бывают трех типов: атомные, ионные и металлические.








Комментирование закрыто