
Все вещества, независимо от их агрегатного состояния (газ, жидкость, твердое тело), представляют собой набор молекул — наименьших частиц данного вещества, имеющих все его химические и физические свойства. Молекулы состоят из двух и более атомов. Температура вещества повышается за счет передачи ему дополнительного тепла, что приводит к росту теплового движения молекул (возрастают скорости перемещений, колебаний и вращений), так как дополнительная тепловая энергия увеличивает их кинетическую энергию.
После проведения похожих экспериментов большинство ученых сошлось во мнении, что причиной такого характера движения частиц являются удары (толчки, импульсы), которые частицы получают от молекул жидкости. С ростом температуры интенсивность движения наблюдавшихся частиц возрастала, откуда следовал естественный вывод, что это происходит из-за роста энергии теплового движения молекул.
Подчеркнем отдельно, что понятия “броуновское движение” и “тепловое движение” — это не одно и тоже. Броуновское движение вторично по отношению к тепловому. Движение невидимых в обычный микроскоп молекул приводит в движение крупные (броуновские) частицы.
Чему равны скорости молекул
Беспорядочное тепловое движение приводит к тому, что в каждый момент времени положение молекул и их скорости не предсказуемы, и имеет смысл говорить о так называемых средних (усредненных) значениях. Этот подход впервые применил английский физик Джеймс Клерк Максвелл, который с помощью математических формул теории вероятностей получил формулу для распределения частиц (атомов или молекул) по скоростям при данной температуре T.
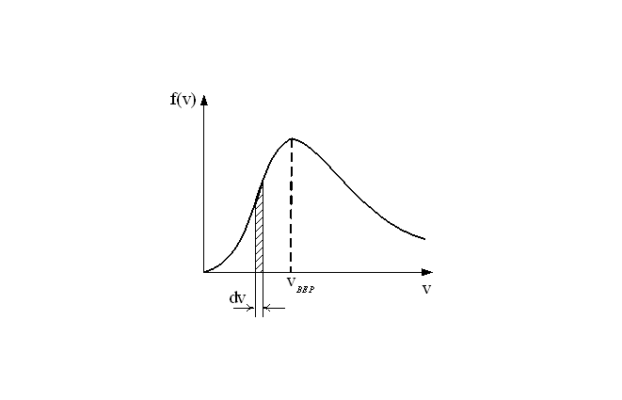
Из графика распределения видно, что оно имеет “колоколообразную” форму. Молекулы с минимальными и максимальными скоростями составляют малую долю от общего числа. Большая часть молекул имеет скорость близкую к vср. С ростом Т увеличивается средняя скорость, а вся кривая распределения смещается вправо. Для средней кинетической энергии Максвелл получил следующую формулу:
$ Е_k = { 3 \over 2} * k * T $ (1),
где: k — постоянная Больцмана.
С другой стороны кинетическая энергия движущейся частицы равна:
$ Е_k = {m * v^2_ср\over 2} $ (2).
Значит:
$ {m * v^2_ср\over 2} = { 3 \over 2} * k * T $ (3).
Воспользовавшись формулой (3), получим выражение для средней квадратичной скорости v2 ср:
$ v^2_ср = { 3* k * T \over m} $ (4).

Для некоторых веществ значения средних скоростей при комнатной температуре 200С приведены в таблице:
|
Вещество |
Формула |
Скорость v ср, м/с |
|
Водород |
H2 |
1930 |
|
Кислород |
O2 |
480 |
|
Гелий |
He |
1365 |
|
Азот |
N2 |
515 |
|
Метан |
CH4 |
680 |
|
Аммиак |
NH3 |
660 |
|
Диоксид углерода |
CO2 |
410 |
|
Вода |
H2O |
640 |
Что мы узнали?
Итак, мы узнали, что такое тепловое движение молекул, и чем оно отличается от броуновского движения. Число молекул с определенной скоростью подчиняется распределению Максвелла. Средняя квадратичная скорость v2 ср описывается формулой (3).








Комментирование закрыто