
Слово атом на греческом языке означает “неделимый”. Учение о том, что в природе все вещества состоят из мельчайших частиц — атомов, возникло благодаря усилиям древнегреческих философов в V-IV в.в. до н.э., а в XVII-XVIII в.в. химики экспериментально доказали справедливость этой теории, показав, что есть предел по расщеплению отдельных веществ на составляющие части. Однако в конце XIX века физики обнаружили, что атом не является неделимым, а состоит из некоторых элементарных частиц: каким сегодня представляют строение атома физики?
Обнаружение электронов в составе атомов любого химического элемента было первым доказательством сложной структуры атомов. На основе полученных результатов Томсон первым, в 1897 г., предложил схему строения атома.

Модель атома, предложенную Томсоном, иногда, для наглядности, называют “пудингом” — английским мучным десертом, в массе которого равномерно распределены изюм или другие ягоды. Томсон полагал, что атом имеет форму шара, состоящего из равномерно распределенного положительного заряда. Внутри этого положительно заряженного объема находятся вкрапления (“изюминки”) электронов. В целом получается, что атом электрически нейтрален. Томсон также предположил, что когда электроны колеблются относительно центра шара, то атом излучает свет.
Однако эта модель не смогла дать объяснения последовавшим далее экспериментам и открытиям.
Некоторые атомы распадаются сами
В 1896 г. французский ученый Анри Беккерель исследовал соли урана. Он обнаружил, что атомы урана испускают не видимые глазом излучения, проникающие через бумагу, и вызывающие почернение фотографической пластинки.
Явление испускания атомами невидимых проникающих излучений назвали радиоактивностью.
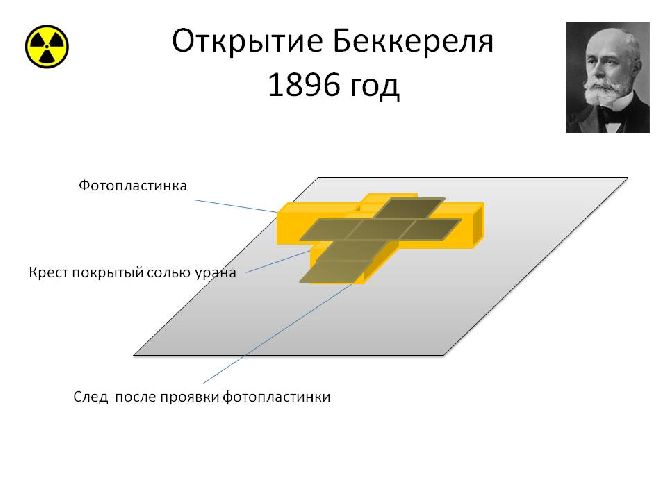
Дальнейшие исследования этого явления показали, что радиоактивные атомы испускают не один тип излучения, а три вида излучений различной физической природы. Эти излучения назвали альфа-, бета- и гамма-лучами. Альфа-лучи α оказались потоком положительно заряженных ионов гелия 4He2, бета-лучи β — потоком электронов, гамма-лучи γ — потоком квантов электромагнитного излучения с очень малой длиной волны, порядка 10-11 – 10-13 м.
Англичане Эрнест Резерфорд и Фредерик Содди доказали, что в результате радиоактивного распада происходит превращение атомов одного химического элемента в атомы другого химического элемента. Например атом урана 235U92 в результате распада превращается в два атома — атом тория 232Th90 и атом гелия 4He2.
Открытие радиоактивного распада окончательно опровергло представление о неизменности, неделимости атомов, что долгое время считалось общей характеристикой для всех атомов.
В 1932 г. английский физик Джеймс Чедвик экспериментально доказал, ядро атома состоит не только из протонов, но и из нейтронов — частиц, не имеющих электрического заряда. Протон и нейтрон притягиваются друг к другу с помощью сильного ядерного взаимодействия. Число нейтронов в ядре равно числу протонов.
Модель атома Резерфорда
Эрнест Резерфорд поставил серию экспериментов, которые позволили ему сделать выдающееся открытие — понять как устроена структура атома. В этих опытах он изучал рассеяние заряженных α – частиц при прохождении через тонкие слои золотой фольги (толщиной порядка 0,1 мкм). За фольгой на экране располагался экран, покрытый слоем сульфида цинка (сульфида цинка ZnS), способного светиться от ударов быстрых заряженных частиц. Было обнаружено, что большинство α – частиц отклоняется от прямолинейного пути на углы не более 1-20. Но небольшая доля частиц отклонялась на значительно большие углы.
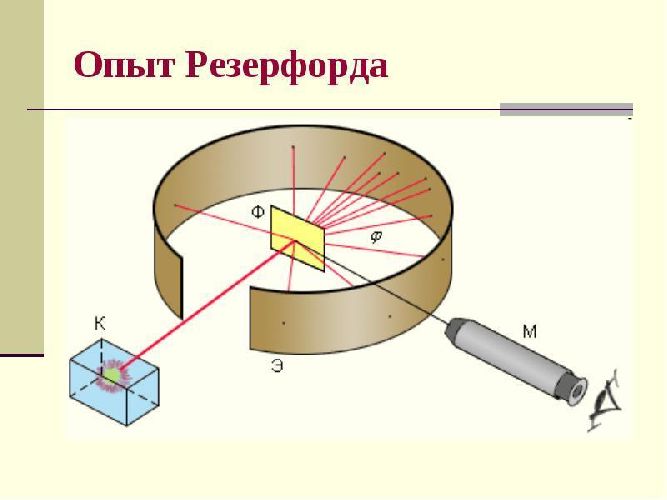
Получив основные сведения из поставленных экспериментов, Резерфорд пришел к следующим выводам:
- Рассеяние α – частиц на большие углы вызвано тем, что положительный заряд в атоме распределен неравномерно, как полагал Томсон, а сосредоточен в центре атома. В этой центральной положительно заряженной части атома — атомном ядре — сосредоточена почти вся масса атома. Резерфорд рассчитал радиус атомного ядра, который оказался равен примерно 10-15 м;
- Атом устроен подобно космической системе планет. Электроны вращаются вокруг атомного ядра как планеты нашей солнечной системы вращаются вокруг Солнца;
- Радиус круговой орбиты самого далекого от ядра электрона равен радиусу атома;
- При столкновении с электронами, масса которых мала, α–частицы отклоняются на небольшие углы;
- Однако в тех случаях, когда быстрая заряженная частица пролетает вблизи от атомного ядра, то под действием сильного электрического поля ядра (положительно заряженного) может произойти отклонение (рассеяние) α–частицы на большие углы, вплоть до 1800.
Эта модель, названная планетарной, позволила объяснить основные закономерности рассеяния заряженных частиц.
Планетарная модель дала объяснение далеко не всем физическим явлением. Дальнейшее развитие модели Резерфорда было сделано датским физиком Нильсом Бором, что привело к созданию нового раздела физики — квантовой механики.
Что мы узнали?
Итак, мы узнали как возникли и развивались представления об атомах. Модель Томсона не смогла объяснить многие экспериментальные данные. Но открытие им электронов, а также опыты Беккереля с радиоактивными веществами, окончательно развеяли представления о неделимости атомов. Планетарная модель атома Резерфорда, построенная им на сновании экспериментов, позволила понять огромное количество явлений в физике, химии и биологии.








Комментирование закрыто