
Спектры, в зависимости от метода их формирования, делятся на два типа – спектры излучения и спектра поглощения. Рассмотрим особенности спектров излучения.
Непрерывные спектры
Первые изученные спектры были радужными полосами, яркость которых менялась плавно. Такие спектры в дальнейшем были названы непрерывными.

Как правило, непрерывные спектры излучаются твердыми или жидкими веществами, нагретыми до определенной температуры. Причем, максимум энергии тем выше, чем выше эта температура. Поэтому непрерывный спектр позволяет оценивать главным образом температурные показатели излучающего вещества.
Линейчатые и полосатые спектры
Совсем другой характер спектра имеет излучение газов. Энергия излучения в таких спектрах концентрируется лишь в некоторых узких областях. В результате спектр выглядит, как ряд узких линий. При изучении линейчатых спектров различных веществ, выяснилось, что расположение этих линий для каждого вещества строго индивидуально. Данное обстоятельство позволило использовать спектральный анализ для определения состава проб неизвестного вещества.
По спектру были открыты даже новые вещества, отсутствующие на тот момент в таблице Менделеева. Инертный газ гелий был открыт благодаря исследованию спектра излучения Солнца, что отражено в его названии (helium – «солнечный»). Лишь через 27 лет удалось получить гелий из минералов на Земле.
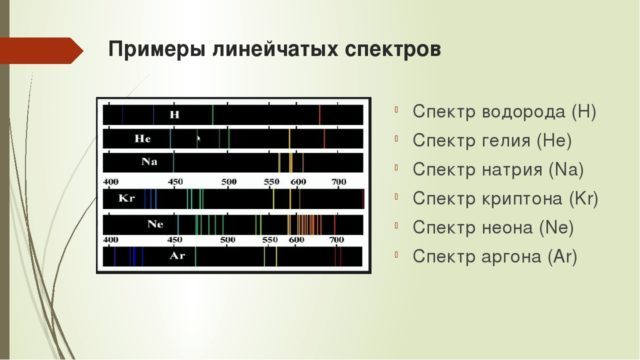
Особым видом линейчатых спектров являются полосатые спектры. Если линейчатые спектры состоят из ряда узких полос, то в полосатых спектрах полосы широки.
Механизм образования спектров
Если вид непрерывных спектров легко объяснялся излучением множества нагретых молекул самой разной энергии, распределение которой соответствует распределению энергии в спектре, то объяснение вида линейчатых и полосатых спектров было получено лишь с построением модели атома Н. Бора.
Согласно модели атома Н. Бора излучение атомов происходит при переходе электронов с одного энергетического уровня на другой. Из-за того, что энергия каждого уровня строго фиксирована, разность этих энергий также будет строго постоянной, в спектре возникнет узкая линия. В рамках модели были объяснены энергии линий спектра, а также получена формула спектра излучения (формула Бальмера)
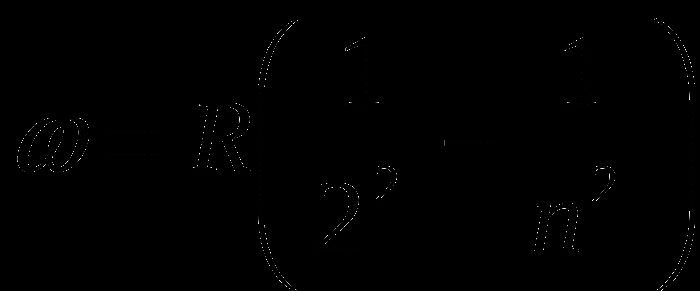
Если излучают не отдельные атомы, а взаимодействующие, то электроны могут переходить между энергетическими уровнями разных атомов, что приводит к появлению большого количества близких линий, сливающихся в широкие полосы полосатого спектра.
Что мы узнали?
Спектры излучения, образуемые нагретыми твердыми или жидкими веществами, имеют непрерывный характер. Атомы газов излучают линейчатые спектры. Если излучающие атомы взаимодействуют друг с другом, то спектры таких атомов становятся полосатыми. Объяснение вида спектров было получено в модели атома Н. Бора.








Комментирование закрыто