
Существование различных агрегатных состояний вещества объясняется тем, что между молекулами существуют силы притяжения и отталкивания. При изменении температуры баланс этих сил и энергии теплового движения изменяется, что и приводит к изменению состояния вещества. Кратко рассмотрим силы взаимодействия между молекулами.
При этом природа этих сил всегда электростатическая. Впервые они были описаны в середине XIX в. Я. Ван-дер-Ваальсом. Поэтому нередко их называют ван-дер-ваальсовыми.
Виды межмолекулярных сил
Из-за того, что силы притяжения между молекулами изменяют пространственную ориентацию и форму самих молекул, они гораздо сильнее изменяются с изменением расстояния, как правило, пропорционально седьмой степени.
$$Fthicksim {1\over r^7}$$
Это убывание гораздо быстрее, чем обычное кулоновское, пропорциональное квадрату расстоянию. Поэтому межмолекулярные силы играют значительную роль лишь на малых расстояниях.
По механизму их возникновения можно выделить следующие.
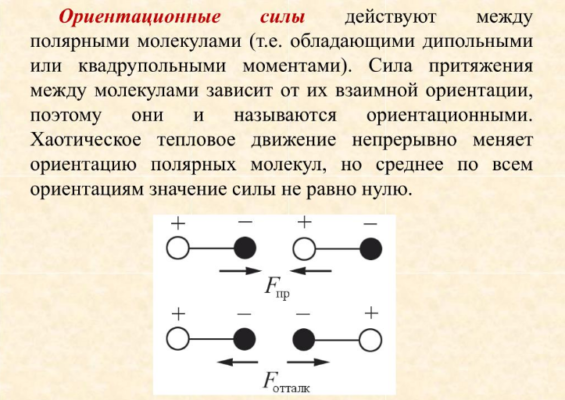
Ориентационные силы
Ориентационные силы еще называют дипольными. Они возникают в результате того, что многие молекулы представляют собой электрические диполи. Разноименные полюса диполей притягиваются, а одноименные — отталкиваются. В результате дипольные молекулы стремятся занять определенное пространственное положение друг относительно друга, что также влияет на величину сил.
В результате ориентационные силы прямо пропорциональны дипольным моментам молекул:
$$F_{ориент} thicksim {p_1p_2\over r^7}$$
Поляризационные (индукционные) силы
Собственный дипольный момент молекул приводит к тому, что он наводит (индуцирует) небольшой дипольный момент у близлежащих молекул, немного «растягивая» их. Если близлежащие молекулы полярны, то индуцированный момент не играет большой роли по сравнению с собственным. Однако, если близлежащая молекула неполярна, то силы небольшого индуцированного момента будут заметны.
Сила взаимодействия будет пропорциональна дипольному моменту полярной молекулы и способности к поляризации под внешним воздействием неполярной молекулы (поляризуемости $alpha$):
$$F_{поляр} thicksim {p_1alpha\over r^7}$$

Дисперсионные силы
Поляризуемость неполярных молекул приводит к тому, что даже между ними возникают силы притяжения.
Хотя в среднем у неполярной молекулы дипольный момент отсутствует, в каждый конкретный момент времени электроны в электронном облаке могут иметь несимметричное положение. В результате мгновенный дипольный момент будет отличен от нуля. То же самое происходит и с соседними молекулами. Суммарное взаимодействие этих мгновенных дипольных моментов приводит к существованию сил притяжения, называемых дисперсионными.
Дисперсионные силы пропорциональны поляризуемостям взаимодействующих молекул:
$$F_{дисп} thicksim {alpha_1alpha_2\over r^7}$$

Что мы узнали?
Силы взаимодействия молекул имеют электростатическую природу. Механизм их возникновения определяется существованием дипольных моментов у молекул. По виду эти силы делятся на ориентационные, поляризационные и дисперсионные. Их величина пропорциональная седьмой степени расстояния, поэтому они проявляются лишь на относительно небольших дистанциях.








Комментирование закрыто