
Основное уравнение молекулярно-кинетической теории газов связывает макроскопический параметр газа — давление — с параметрами молекул. Рассмотрим кратко вывод этого уравнения.

Давление идеального газа
Одним из объектов, который хорошо описывается с помощью МКТ, является идеальный газ.
В идеальном газе молекулы представляют собой материальные точки, которые хаотически движутся в предоставленном объеме, сталкиваясь друг с другом и со стенками сосуда. Столкновения абсолютно упруги, и других взаимодействий между молекулами нет.

Учитывая основные положения МКТ газов, становится возможным связать величину давления с параметрами его молекул. В упрощенном виде ход рассуждений будет таким.
Для определения давления учтем, что, если средняя скорость молекулы равна $v_{ср}$, то импульс, переданный ею при абсолютно упругом ударе о стенку сосуда, равен:
$$Δp =2m_0|v_{ср}|$$
Если концентрация молекул равна $n$, то количество ударов молекул о стенку сосуда площадью $S$ за время $t$ равно:
$$Z=n|v_{ср}|St$$
А полный импульс силы, подействовавший на стенку, равен:
$$Ft=2m_0|v_{ср}|Zt$$
Из двух последних формул найдем силу:
$$F=2nm_0v_{ср}^2S$$
Поскольку в ударах о стенку сосуда участвовали лишь молекулы, имеющие составляющую скорости, перпендикулярную стенке и направленную в ее сторону, то в среднем импульс передавала только одна шестая молекул (в трехмерном пространстве молекулы могут двигаться в шести направлениях). Следовательно, среднее значение силы в шесть раз меньше полученного значения:
$$\overline F={1\over 3}nm_0v_{ср}^2S$$
Поделив полученное значение силы на площадь, получим создаваемое ею давление:
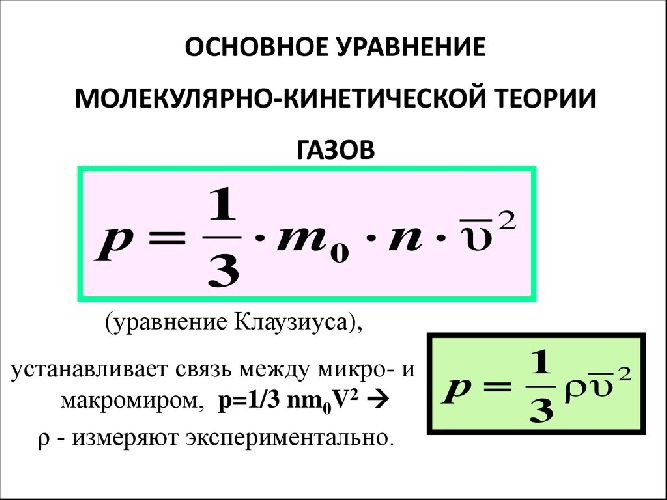
$$p={1\over 3}nm_0v_{ср}^2$$
Полученная формула — это и есть основное уравнение молекулярно-кинетической теории газов.
Иногда основное уравнение МКТ записывается с использованием средней кинетической энергии молекулы. Средняя кинетическая энергия равна:
$$E_{ср}={m_0v_{ср}^2\over 2}$$
Выражая среднеквадратичную скорость из этой формулы и подставляя ее в предыдущую, получим:
$$p={2\over 3}nE_{ср}$$
Давление идеального газа пропорционально концентрации и средней кинетической энергии молекулы.
Что мы узнали?
Основное уравнение молекулярно-кинетической теории идеального газа связывает макроскопический параметр газа — давление — с параметрами его молекул: с концентрацией, массой и средней скоростью. Поскольку масса и средняя скорость молекулы однозначно определяют среднюю энергию молекулы, основное уравнение МКТ можно записать с помощью средней энергии.








Комментирование закрыто