
Опыты показывают, что основные макроскопичекие параметры газа (объем, температура, давление) тесно взаимосвязаны. При исследовании этой связи были открыты закономерности, названные газовыми законами. Рассмотрим кратко данную тему.
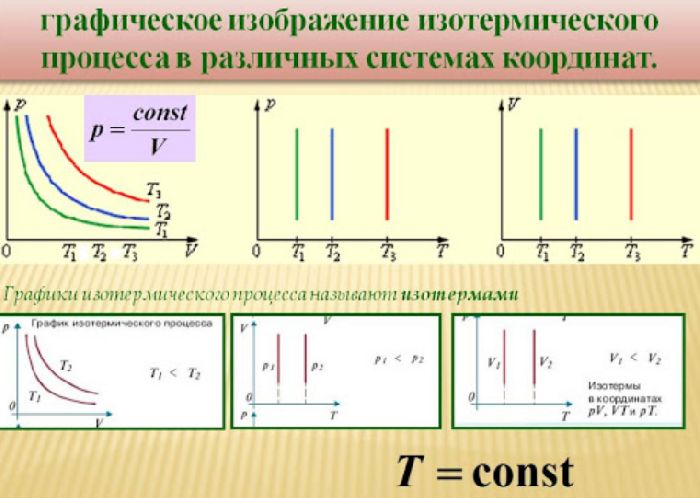
Таким образом, закон Бойля-Мариотта выражает зависимость давления от объема газа при фиксированной температуре. График этой зависимости называется изотермой и в координатах $V–p$ представляет собой гиперболу, располагающуюся тем выше, чем выше температура. В других координатах изотерма является горизонтальной или вертикальной прямой.
Закон Шарля
Хронологически вторым открытым газовым законом является закон, открытый Ж. Шарлем в 1787 г.
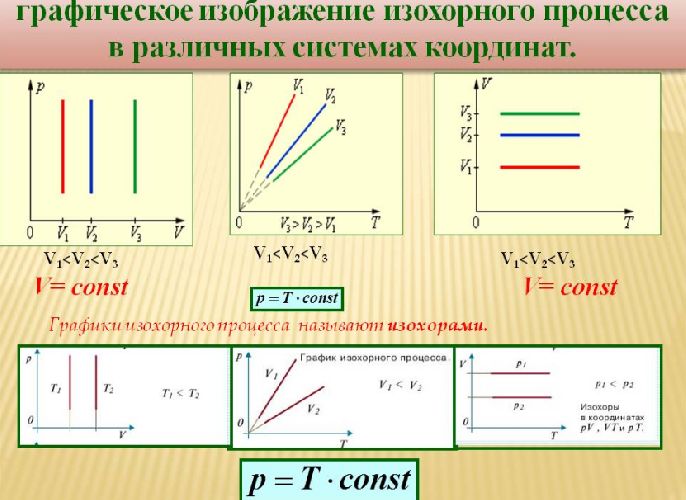
Было установлено, что давление фиксированного количества газа при фиксированном объеме изменяется прямо пропорционально его температуре. Отношение этих величин постоянно:
$${p\over T}=const$$
Данный процесс называется изохорным, и его график в координатах $Т-p$ является наклонной прямой, направленной из начала координат. Прямая поднимается тем круче, чем меньше объем газа. В других координатах график изохоры является горизонтальной или вертикальной прямой.
Закон Гей-Люссака
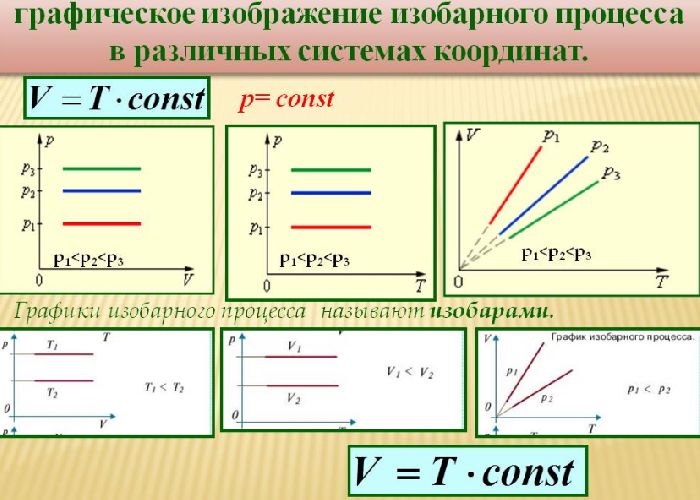
В 1802 г Ж. Гей-Люссаком был опубликован третий газовый закон, описывающий изменение состояния фиксированного количества газа при постоянном давлении. Он гласит, что объем фиксированного количества газа при постоянном давлении пропорционален температуре. Отношение этих величин постоянно:
$${V\over T}=const$$
Такой процесс был назван изобарным, и его график в координатах $Т-V$ является наклонной прямой, направленной из начала координат. Прямая поднимается тем круче, чем меньше давление газа. В других координатах график изобары является горизонтальной или вертикальной прямой.
Уравнение Менделеева-Клапейрона
В 1834 г Э. Клапейрон, исследуя три перечисленных закона, и обобщая их, получил уравнение, названное его именем, и связывающее все три макроскопических параметра газа:
$${pV\over T} = const$$
Это уравнение хорошо подходило для описания изменений для фиксированного количества определенного газа. Однако, константа, входящая в него, оказывалась для каждого газа разной, зависящей от исследуемого количества. Необходимо было получить более универсальную формулу.
Основой такой универсальной формулы явился закон, открытый в 1811 г. А.Авогадро. Он гласит, что равные объемы газов при равных давлениях и температурах содержат одинаковое число молекул.
В 1874 г Д. Менделеев установил, что постоянная, присутствующая в уравнении Клапейрона, прямо пропорциональна этому числу. А значит, можно ввести универсальный коэффициент пропорциональности R, физический смысл которого состоит в том, что это количества тепла, которое надо передать одному молю газа для того, чтобы нагреть его на 1К. С использованием этой универсальной газовой постоянной, уравнение приняло вид:
$$pV ={m\over M}RT,$$
где:
- $p,V,T$ – макроскопические газовые параметры;
- $m$ – масса газа;
- $М$ – молярная масса газа (масса моля газа, содержащего $N_A=6×10^{23}$ молекул);
- $R$ – универсальная газовая постоянная, равная $R=8.31 {Дж \over моль × К }$.
Уравнение состояния газа в таком виде связывает макроскопические термодинамические параметры идеального газа (объем, температуру, давление) с его физическими параметрами (массой и молярной массой), и называется уравнением Менделеева-Клапейрона. Основные газовые законы являются его следствием.
Что мы узнали?
Газовые законы связывают два макроскопических термодинамических параметра газа. Третий параметр, а также вид газа и его количество предполагается фиксированным. Обобщением газовых законов является уравнение Менделеева-Клапейрона, в котором термодинамические параметры связываются с физическими параметрами газа.








Комментирование закрыто